【8.3.5.2】IRES介绍
基因表达的转录调控已被广泛研究。最近,人们越来越认识到翻译调控在基因表达中的作用,导致了许多新的领域参与翻译研究。蛋白质合成的调节对细胞生长、发育和存活至关重要,并且主要在起始步骤受到控制。真核细胞利用多种机制启动翻译,这取决于细胞应激、生长条件、病毒感染或mRNA中存在的序列。
- 虽然绝大多数信使核糖核酸是以帽依赖的方式翻译的,但信使核糖核酸的一个重要子集有一种替代机制,即核糖体在内部被募集到信息中,以启动帽非依赖性翻译。其中一些信使核糖核酸含有位于5′非翻译区(UTR)的内部核糖体进入位点(IRES)。
- 然而,要确定RNA元件是功能性IRES,需要对特定对照进行大量仔细执行的实验。这篇综述将清楚地解释所需的实验,以及用于确定RNA元件是否起到IRES的作用以促进翻译启动的各种试验的优缺点。
我们希望,揭开公认的IRES活动检测方法的神秘面纱,将向更广泛的社区开放对这一重要机制的研究
转录调控在基因表达中起着重要作用。然而,并不是所有的信使核糖核酸都是以相同的效率产生和翻译的;相反,真核细胞使用多种手段在蛋白质合成水平上调节基因表达。翻译在启动过程中主要受到调控,无论是全局调控还是通过RNA中的序列进行信息特异性调控。翻译控制在分化、细胞生长、有丝分裂、血管生成和细胞凋亡中起着重要作用。因此,翻译起始的失调对肿瘤细胞的生长、存活、侵袭和转移有重要贡献。许多编码肿瘤发生所需蛋白质的细胞信息利用IRES介导的起始蛋白质合成机制。这些信息编码的蛋白质通常表达量较低,但对细胞程序(如转录因子)有显著影响。很明显,帽依赖性翻译是细胞的工作马(work-horse ),它被用于体内所需的蛋白质,如β-肌动蛋白。然而,当细胞遇到困难时期(如饥饿、缺氧或凋亡)时,它会通过帽依赖性翻译的显著全局减少来停止蛋白质合成的能量需求过程。为了应对压力或进入程序性细胞死亡,细胞需要合成某些蛋白质。这些蛋白可能由含有IRES的信使核糖核酸编码
这篇综述的重点是鉴定信使核糖核酸中的功能性IRES。虽然首次在哺乳动物病毒中发现IRES 但不久后第一个细胞IRES就被发现了。现在,估计有10%至15%的细胞信使核糖核酸含有IRES。这一估计是基于在各种条件下进行的多次实验,当时IRES介导的翻译是受欢迎的。这些类型的实验撒下了一个大网,虽然它们提供了一些细胞信息可能含有IRES的迹象,但在证明蛋白质表达是IRES依赖性的方面,它们远远达不到标准。这必须对每一个进行实验证明,并且必须进行一系列控制。为确定RNA元件具有IRES活性所做的大部分努力都花在了对照实验上,这些实验排除了它可能是IRES活性以外的任何其他物质的可能性
一、启动翻译的机制
启动翻译有两种基本机制:帽依赖性和帽非依赖性。然而,这些基本机制存在差异,理解启动蛋白质合成的所有机制很重要,因为必须排除这些机制才能建立IRES活性
1.1 帽依赖
大多数真核细胞信使核糖核酸是使用帽依赖性翻译机制翻译的,
- 其中10至13个真核细胞起始因子(eIFs,eukaryotic initiation factors)具有识别信使核糖核酸上5′帽结构的功能,
- 将40S核糖体亚基募集到信使核糖核酸的5′端(图1a),
- 向下扫描信息以定位AUG起始密码子,
- 并促进60S亚基连接以形成具有翻译活性的80S核糖体。
关于帽依赖翻译的更详细讨论,请参阅最近的其他综述。然而,有必要简要回顾这些因素的作用,因为其中几个因素在IRES介导的翻译中也很重要。在依赖性翻译中,5′帽结构被一种复合物识别,该复合物包括鞘结合蛋白(eIF4E,cap-binding protein)、支架蛋白(eIF4 G,a scaffold protein)和RNA解旋酶(eIF4A,an RNA helicase)。该复合物将43S起始前复合物(40S亚基、eIF1、eIF5、eIF1A、eIF2•met-tRNAi•GTP和eIF3)募集到mRNA的5′近端区域。40S亚基沿着信息在5′到3′方向上扫描,直到起始密码子AUG被识别并GTP被水解。然后60S亚基结合形成80S复合物。这种复合物过程为细胞提供了启动的效率和全局或以特定信息的方式调节翻译的多种途径。
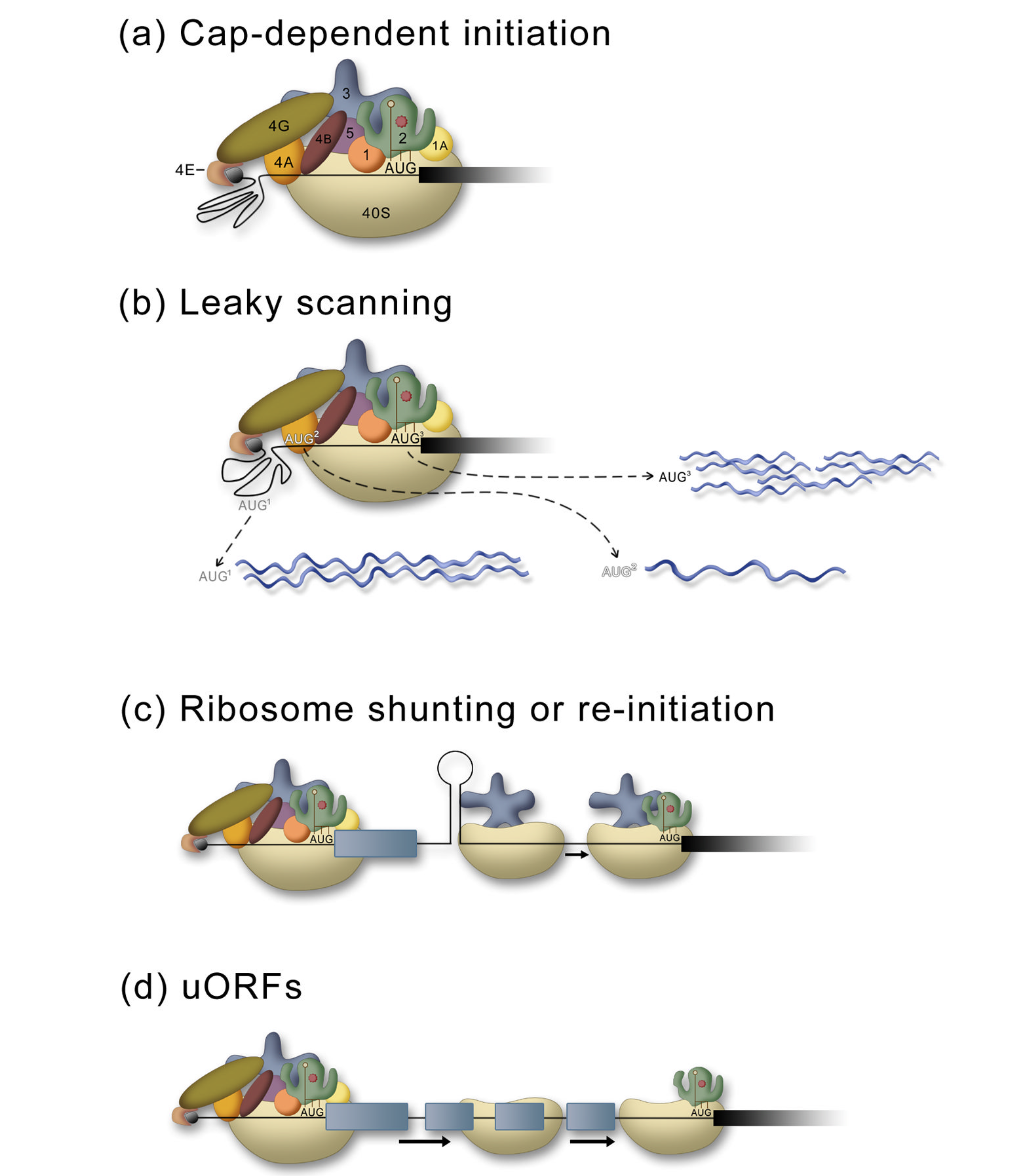
Figure 1 Mechanisms of cap-dependent translation. (a) The standard cap-dependent mechanism involves recognition of the 5′cap (black) by a complex of eukaryotic initiation factors (eIF) eIF4E, eIF4G, and eIF4A that recruit the 43S pre-initiation complex (40S subunit, eIF1, eIF5, eIF1A, eIF2•met-tRNAi•GTP, and eIF3. This generates a 48S complex and the 40S ribosomal subunit scans down to the first AUG. The 60S subunit then joins and protein synthesis begins (not shown). (b) In leaky scanning, the 40S subunit can bypass AUGs that are in a poor sequence context to generate proteins (blue) that have alternate N-terminal ends. Here, the darker the AUG, the better the sequence context, and thus the more likely that it will be used to initiate protein synthesis. (c) Ribosome shunting requires recruitment of the ribosome through a cap-dependent mechanism as in (a), then, following scanning or translation of a short ORF the ribosome is shunted (no scanning) downstream to initiate protein synthesis. (d) The presence of uORFs can prevent translation of the major coding region unless levels of the eIF2•met-tRNAi•GTP are low. The ribosome is brought to the 5′end as in (a), then following translation of the first uORF the 40S subunit remains associated with the mRNA and continues to scan down the mRNA until it acquires another eIF2•met-tRNAi•GTP, enabling it to initiate translation at the next ORF.
泄漏扫描、uORF和核糖体分流 Leaky Scanning, uORFs, and ribosomal shunting
在脊椎动物中,被扫描核糖体抵消的第一个良好Kozak共有序列上下文(5′-GCCGCCC(A/G)CCAUGG-3′)用于启动蛋白质合成。通过上游起始密码子的泄漏扫描(图1b)可以发生mRNA特异性调节,或通过位于主要蛋白质编码序列上游的上游开放阅读框(uORF)的存在(图1d)。短uORF允许在停止密码子终止后继续扫描40S核糖体亚基。当三元复合物(eIF2•met tRNAi•GTP)较低时,扫描40S亚单位需要更长的时间才能获得新的三元复合体(识别起始密码子所需),并且它可以绕过其他起始密码子(uORF),直到获得三元合物。40S亚基的末端将在到达主编码序列的起始密码子之前获得三元复合物,并启动蛋白质合成
。
核糖体分流或重新启动(Ribosome shunting or reinitiation)涉及核糖体帽依赖性内切酶的不连续扫描(图1C)。核糖体以帽依赖的方式被募集到信息的5′端,40S亚基可能翻译或不翻译短uORF,然后a5′供体位点将40S亚单位转移或分流到3′受体位点,绕过大片段的信使核糖核酸(无需扫描)在下游启动翻译。核糖体分流的分子机制尚不清楚,节点化序列或RNA结构普遍与分流有关
1.2 不依赖帽
不依赖于帽的翻译就是不需要a5′帽结构的蛋白质合成的起始。已经描述了两种由IRESs或cap非依赖性翻译元件(CITE)介导的机制。
IRESs的功能是通过将核糖体内部募集到mRNA中(图2a)。IRES可以与启动因子结合,启动因子反过来募集核糖体亚基(如小核糖核酸病毒IRES),它可以直接与核糖体亚基结合(如蟋蟀麻痹病毒基因间区和丙型肝炎病毒IRESs),或者它可以与rRNA序列碱基配对,类似于用于原核生物启动的shine Dalgarno序列。
目前尚不清楚CITE是一种独立的机制还是IRES的变体。通常CITE位于3′UTR,但它们也可以在5′UTR中有效发挥作用,这表明它们提供了一种增加核糖体近端至起始密码子浓度的机制,无论它们是在5′UTR中,还是通过长距离碱基配对使信使核糖核酸环化而接近5′UTR。CITE通过结合eIF4G(支架蛋白)或/和eIF4E(帽结合蛋白)将翻译机制募集到RNA中(图2b)。到目前为止,CITE仅在植物RNA病毒中被鉴定。目前尚不清楚这些CITE是否可以作为IRES发挥作用,或者它们是否需要游离的5′端。翻译场(translation field)等待产生具有CITE元件的环状RNA(见下文)
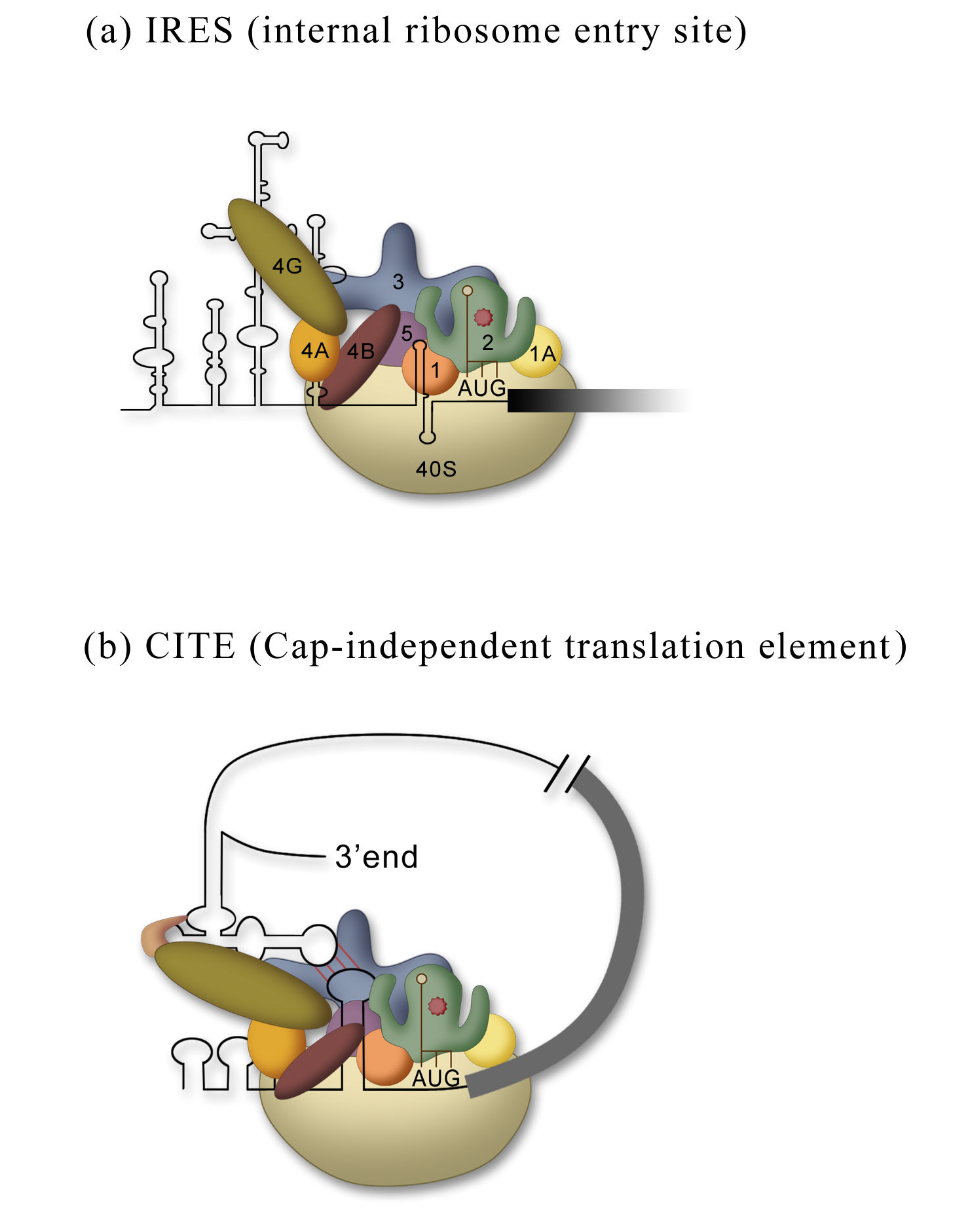
Figure 2 Mechanisms of cap-independent translation. (a) IRESs recruit the 40S subunit internally to the mRNA using anywhere from all to none of the translation initiation factors (defined in Fig. 1a). (b) A CITE located in the 3′UTR binds to the cap-binding complex (eIF4E, eIF4G, and eIF4A) and through circularization of the mRNA recruits a 43S pre-initiation complex to 5′UTR of the mRNA.
二、什么是IRES
IRES是通过一种功能测定来定义的,该功能测定确定RNA元件或序列能够在内部将核糖体募集到信息中。IRES只能通过实验来识别。没有一致序列或RNA结构来定义IRES。IRES无法进行生物信息学预测。事实上,短的非结构化序列和长的结构化5′UTR都已被证明具有IRES活性。以下特征可能表明mRNA包含IRES:
- 如果它包含多个未使用的上游起始密码子(这也可能表示uORF的调控(图1d),如酵母GCN4 mRNA所示)。
- 如果它是长的和/或结构化的;这降低了扫描的效率,并可能表明在5′UTR内存在IRES。
- 如果蛋白质在压力或帽依赖性翻译减少的条件下表达,而转录物丰度没有相应变化。
然而,这些因素都不能确定信使核糖核酸是否含有IRES,而是必须与几个对照实验一起进行功能分析(详见下文)
人们对病毒性IRES有了更多的了解,因此病毒和细胞性IRES之间经常有相似之处。它们在机制方面可能有一些相似之处,但它们的目的却截然不同。病毒IRES是高度结构化的,其目标是产生尽可能多的病毒蛋白,因此这些IRES通常(但并不总是)是已知的最活跃的IRES之一。然而,当帽依赖性翻译被抑制时,细胞IRES可以允许蛋白质的持续或诱导表达。因此,含有IRES的细胞RNA可能使用帽依赖性翻译,并且只有当帽依赖性转化减少时才转换为IRES介导的翻译。或者,cellular mRNA可能存在于细胞中,但只有当帽依赖性翻译被下调且IRES介导的翻译占主导地位时才被翻译。事实上,细胞信息可以使用两种启动翻译的机制,这使得很难区分人群中使用的不同翻译机制的贡献。因此,这需要将5′UTR引入IRES报告(见下文),以评估其是否能够进行IRES介导的翻译
三、评估IRES活动
3.1 双顺反子报告基因测定 Bicistronic reporter assay
一般来说,负面结果(negative result)在科学上是最难证明的,但对IRES活动的评估并非如此。做一个单独的实验并排除IRES的可能性要比最终证明IRES的活性容易得多。用于IRES活性测试的最常见和最简单的方法是将推定的IRES序列克隆到DNA双顺反子报告子中,并测定第二顺反子的表达(图3a)。顺反子可以是任何可以容易量化的蛋白质;常用的报告基因是Renilla和萤火虫萤光素酶,以及β-gal。我们已经观察到,在将DNA质粒瞬时转染到组织培养细胞中后的24小时和48小时内发生双链报告基因的最佳翻译。第一顺反子的表达将是帽依赖性的,而第二顺反子可以是IRES依赖性的。帽依赖性翻译非常有效,并且帽依赖性报告子的相对活性将比第二顺反子的表达高得多(通常高出几个对数)。对照(空)双顺反子报告子应用于比较和建立基线。
双顺反子转运子可能具有一些“填充物”结构的序列,这些序列阻止第一顺反子的终止密码子读穿以翻译第二顺反子。这些序列可以是不具有IRES活性的超结构RNA序列,如ΔEMCV IRES序列,也可以具有额外的终止密码子和将第一顺反子置于第二顺反子之外的序列。这里的目标是尽可能减少第二顺反子的背景表达(由于终止密码子的通读或核糖体的持续扫描)。如果对照双顺反子报告子表现出高的翻译背景水平(与没有报告子的测定相比),则可以采取步骤降低第二顺反子表达的背景水平(如上所述)。
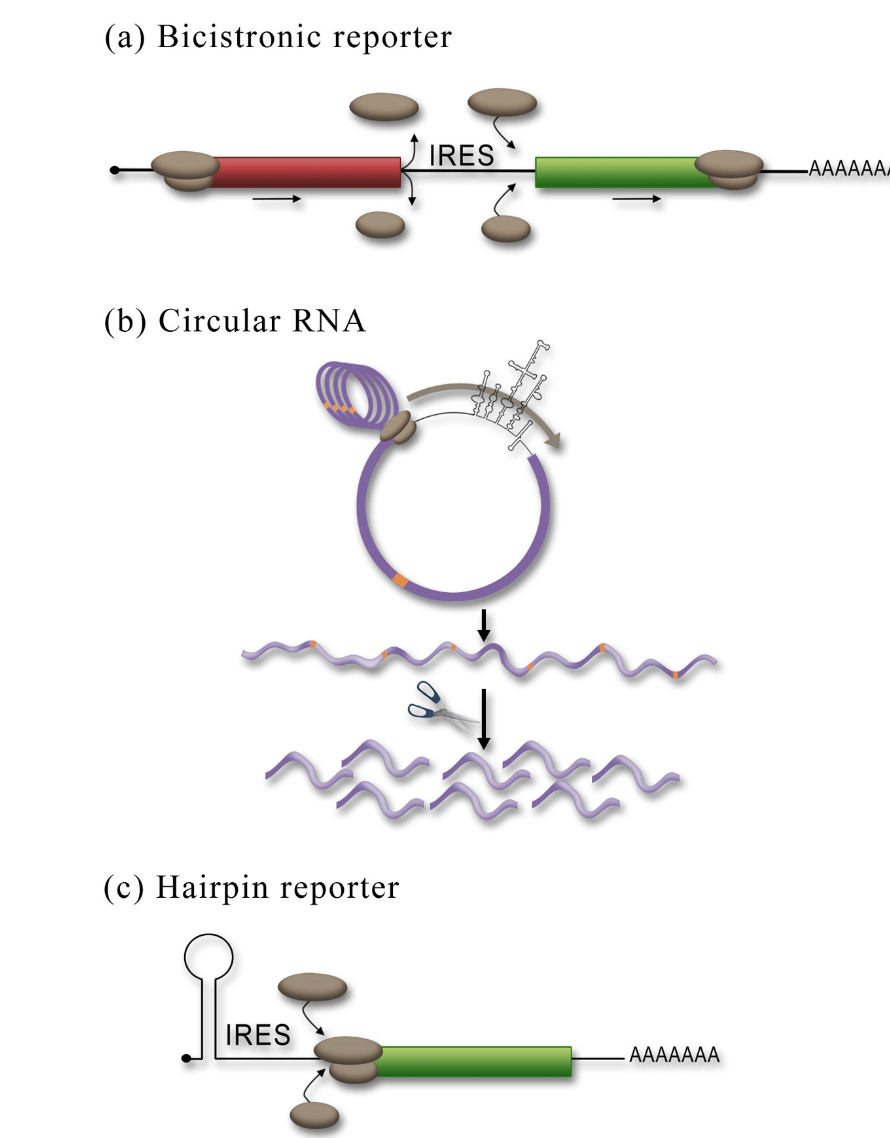
Figure 3 Reporter assays used to assess IRES activity. (a) In the bicistronic reporter assay the IRES is placed between two cistrons. Expression of the first cistron (red) is cap-dependent whereas expression of the second cistron (green) is dependent upon a functional IRES. The ribosomal subunits are shown (brown). (b) Insertion of an IRES into a circular RNA ensures that expression of the reporter is due to internal initiation since there is no free 5′end. The removal of all the stop codons in the circular RNA allows for the generation of a single continuous ORF, such that multiple rounds of translation around the circle demonstrates that the circle is intact. Insertion of a protease cleavage site (orange) allows for the collapse of the polyprotein into a single protein product consistent with the ribosome transversing around the circle once. (c) Insertion of a stable hairpin in the 5′UTR can be used to block cap-dependent translation. Therefore translation of the cistron would be dependent upon a functional IRES upstream of the reporter ORF.
如果双顺反子报告子测定表明第二顺反子的表达与对照(空的)双顺反基因报告子相似,那么很可能没有IRES活性,翻译调节很可能通过不同的机制进行。如果在双顺反子报告基因测定中没有检测到IRES活性,那么这通常是实验的结束,只要起始AUG起始密码子与报告基因编码区一致。一些IRES通过向下扫描到AUG来启动翻译,然而,一些IRES直接在起始密码子处组装40S亚单位。因此,AUG相对于IRES的位置可能很重要(并且可能是AUG之后的前几个密码子)。然而,为了严格排除IRES的可能性,应该包括IRES下游包括部分编码区的序列,因为有时这些序列可能有助于IRES活性。或者,如果推定的IRES序列导致第二顺反子的表达水平明显高于对照,那么这可能表明IRES存在。然而,还需要额外的实验和对照来确定第二顺反子的表达不是由于技术人工产物,如神秘启动子活性或神秘剪接位点的引入(见下文)
环状RNA
双顺反子报告子测定法是检测IRES活性最常用的测定法,但也有其他完全可接受的测定方法,例如将推定的IRES序列插入环状RNA中。由于帽依赖性翻译需要游离的5′端,因此可以使用缺乏游离5′端的环状RNA的产生来证明核糖体在内部被募集到mRNA中(图3b)。因此,如果发生翻译,必须通过内部启动。简言之,含有推定IRES和下游报告蛋白的RNA是通过体外转录产生的,并使用将5′端和3′端连接在一起的桥接寡核苷酸进行环化。T4 DNA连接酶用于将末端连接在一起。循环RNA可以基于其相对于线性对应物的凝胶迁移率降低而被凝胶分离。
使用环状RNA最严格的证明是消除所有的终止密码子,这样核糖体将在环状RNA周围多次翻译,以产生长的重复多蛋白链(图第3b段)。这表明broken RNA上没有发生翻译。可以将单个蛋白酶切割位点引入序列中,并且在添加蛋白酶后,多蛋白应该坍塌为大小与核糖体相当的单个蛋白质,核糖体在环周围翻译一次。虽然来自环状RNA的蛋白质表达是IRES的明确证据,这种方法在技术上更困难,并且可能会受到下面列出的RNA转染的一些注意事项的影响,这些注意事项可能会导致假阴性
5′发夹
可用于评估IRES活性的第三种测定方法是在mRNA的5′端引入稳定的发夹结构,以阻断帽依赖性翻译。发夹阻断帽依赖型翻译,但不应对IRES介导的翻译产生影响。原则上,5′发夹可以引入双顺反子或单顺反子报告子。在单顺反子构建体中,含有报告子的帽依赖性翻译不会被抑制(含有推定IRES元件的报告子与不含发夹的翻译活性的比较)。在细胞mRNA中添加5′毛蛋白是检测IRES活性的有效方法,从而使IRES的序列背景发生最小变化。这种方法的一个潜在警告是,如果发夹没有足够靠近5′端或不够稳定,那么它将不会完全抑制帽依赖性翻译。因此,重要的是生成具有帽依赖性5′UTR(如β-肌动蛋白)的对照报告子,以证明发夹完全阻断帽依赖性翻译。在双顺反子上下文中,发夹会抑制第一顺反子的翻译,但IRES可能不会影响第二顺反子翻译。双顺反子发夹报告子可以与缺少发夹的同一报告子的表达进行比较。
RNA IRES报告
RNA双顺反子报告子用于评估IRES活性并不罕见。RNA报告子可以在体外合成并转染到哺乳动物细胞中。虽然RNA转染对病毒IRES有效,但有报道表明,细胞IRES需要“核经验”才能发挥作用。关于这一点的争议在翻译领域仍未解决。目前还没有明确的证据表明这种核经验是如何“激活”细胞IRES的。这些可能性可能包括mRNA的修饰(通过甲基化、假尿苷化或其他mRNA修饰)或RNA结合蛋白的结合。被称为IRES反式因子(ITAFs)的RNA结合蛋白是某些IRES活性所必需的(综述见34)。一般来说,ITAFs要么仅为细胞核,要么为已知在细胞核和细胞质之间循环的蛋白质。很少有ITAFs仅位于IRES活跃的细胞质中。这表明IRES可能需要通过细胞核才能获得这些蛋白质。这场争论的另一方认为,某些IRES在DNA中比在RNA报告子中更具活性,这证明“IRES”活性实际上是由细胞核中的神秘启动子或异常剪接事件引起的。虽然这种批评显然是有道理的,因为某些研究错误地分配了IRES活性,而事实上没有IRES,但很明显,某些细胞信使核糖核酸和病毒核糖核酸含有功能性IRES。对照不足的研究的合理批评不能用于推广到所有细胞IRES研究。
3.2 IRES活性的体外检测
到目前为止,我们只讨论了体内测定,但有几种商业上可用或已发表的方法可以产生翻译活性提取物。最受欢迎且易于使用的是兔网织红细胞裂解物(RRL)。使用该系统需要注意的是,RRL的设计目的是最大限度地翻译引入它的任何信使核糖核酸。因此,可以发生不依赖于5′7mGpppG帽或apoly(a)尾的非特异性翻译起始。因此,需要建立对照来证明特异性启动。此外,一些细胞和病毒IRES在细胞自由翻译系统中不能有效翻译。最后,值得一提的是,一些IRES只有在补充了来自HeLa细胞的核糖体盐洗涤部分以提供ITAF的情况下,才能在RRL中有效发挥作用。
也就是说,有几种很好的体外翻译试验可以为IRES(或对抗IRES)增加支持性证据。特别地,eIF4E(帽结合蛋白)可以通过向具有翻译活性的HeLa细胞裂解物中添加过量的帽结构来耗尽或合成;由于IRES不需要eIF4E(甲型肝炎病毒除外),因此消耗不应影响IRES介导的翻译。此外,许多IRES在eIF4G(支架)被切割时发挥作用,就像脊髓灰质炎病毒阻断帽依赖性翻译一样。因此,当eIF4G通过添加2A蛋白酶而被切割时,翻译的增加或等效是IRES活性的良好支持证据
3.3 消除双顺反子报告中第二顺反子表达的技术原因
如果已经观察到双顺反子报告子中第二顺反子的表达,下一步是排除其他非IRES依赖性原因,如神秘启动子活性、剪接事件的激活、通读或核糖体分流。最常见的假阳性是由神秘的启动子活性引起的。
排除神秘启动子
神秘启动子(cryptic promoter)可以产生单独的单顺反子信使核糖核酸,该信使核糖核酸包含通过帽依赖性机制表达的第二顺反子(图4a)。重要的是,除了全长双顺反子报告子外,这种转录物也可以存在。因此,对照不仅必须证实全长双顺反子报告子被表达,而且必须证明没有较小的转录物被表达,从而可以产生功能性的第二顺反子蛋白。有两种方法可以统治密码外启动子。第一种也是最标准的方法是northern分析,以检测产生的所有RNA转录物。探针应靶向第二顺反子中对报告活性至关重要的序列,以检测可能负责或有助于第二顺顺反子表达的较短转录物。即使是来自弱隐蔽启动子的少量单顺反子RNA,也会通过帽依赖机制导致第二顺反子的显著表达水平。因此,来自北方的信号必须足够强烈(甚至过度暴露),才能检测到来自隐信息素的低水平信号。话虽如此,根据我们的经验,northern 分析很容易检测到神秘的启动子活性
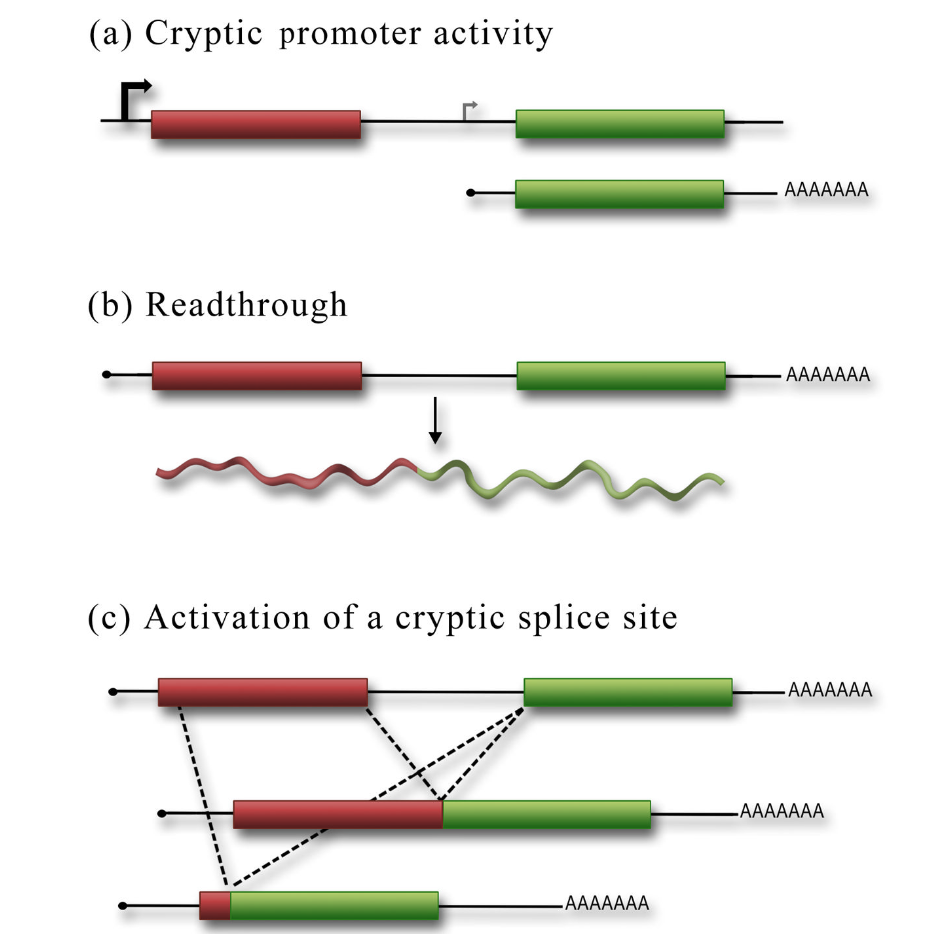
Figure 4 Controls for the bicistronic reporter assay must be performed to rule out all possible reasons for second cistron expression aside from IRES activity. (a) The sequences inserted within the bicistronic reporter may contain weak or cryptic promoter activity that would result in the expression of a monocistronic mRNA that can be translated by the cap-dependent mechanism. (b) Readthrough of the stop codon in the first cistron would generate a chimeric reporter protein that would be translated using a cap-dependent mechanism. (c) The inserted sequences in the bicistronic reporter may contain a cryptic splice site that would generate either a chimeric protein (as in (b)) or a monocistronic RNA that encodes the second cistron. These spliced products would result in cap-dependent expression of the second cistron.
一种替代northern分析的方法是进行RT-PCR(逆转录聚合酶链式反应)来检测较短的转录物。已经使用的另一种PCR方法使用实时PCR来比较第一顺反子和第二顺反子的RNA水平。如果它们的水平相等,则被视为仅产生全长双顺反子信使核糖核酸的证据。然而,我们提醒读者,聚合酶链式反应只检测基于所用引物预测的结果。聚合酶链式反应可能会错过意想不到的转录物,这是一个很大的风险。核糖核酸酶保护检测的灵敏度是northern 的10倍。然而,RNase保护测定与RT-PCR。存在相同的问题,即除非正确预测异常转录物,否则可能会错过。换句话说,RNase保护测定在确定存在哪些与探针杂交的转录物方面非常有用,但它不能检测到可能存在但未被探针识别的转录物。识别任何意想不到的转录物对于排除IRES活动的阳性至关重要。
RNase保护测定可用于鉴定异常转录物中的序列,以确定其是否是神秘启动子或剪接的结果。因此,我们认为northern分析是对神秘启动子和神秘剪接位点最严格的测试。考虑到第二顺反子表达是双顺反子报告子中的一个神秘启动子的最常见解释,我们进行的第一个对照是northern
Richard Lloyd开发了一种RNAi测定法来评估双顺反子cDNA报告基因的转录物。简言之,靶向第一顺反子的siRNA或对照siRNA用双顺反基因报告基因转染到报告细胞中。如果只产生完整的双顺反子RNA,那么两个顺反子都会受到同样的影响。因此,当第二顺反子没有被击倒到与第一顺反子相同的程度时,就表明了隐启动子的活性。然而,这种方法无法确定这些异常转录物的原因,也无法检测连接顺反子或第一顺反子终止密码子的剪接转录物的贡献。因此,正如作者所说,这种测定必须与其他实验相结合,如无启动子分析和无启动子报告子。
通过将无促质子DNA报告基因转染到哺乳动物细胞中,获得了不存在神秘启动子的实验证据。在没有启动子的情况下,不产生mRNA,因此不应检测到蛋白质表达。如果没有检测到第二顺反子活性,这就反对神秘的启动子,从而反对IRES。然而,如果检测到来自第二顺反子报告子的活性,这表明存在神秘启动子,因此第二顺顺反子的表达可能是通过帽依赖性机制
排除剪接、通读和分流 Ruling out splicing, readthrough, and shunting
IRES将促进第二顺反子的表达,而与第一顺反子是否被翻译无关。然而,如果第二顺反子的表达是由异常剪接事件、核糖体搜寻或上游终止密码子的通读引起的,那么抑制第一顺反子翻译将对第二顺顺反子表达产生显著影响。有几种方法可以抑制第一顺反子的帽依赖性翻译。然而,最干净的是在双顺反子报告子的5′端附近引入一个稳定的茎环结构。这提供了空间位阻来抑制双顺反子信息5′端40S亚基的负载。如果发夹仅抑制第一顺反子的翻译,则表明IRESis独立驱动第二顺反子。然而,如果第二顺反子也被抑制,那么剪接、通读或核糖体分流可能是帽依赖性机制中第二顺顺反子表达的一部分,如果不是全部的话
另一种证明第二顺反子表达独立性的测定通过使用A-cap(ApppA)阻断帽依赖性翻译。虽然A-帽具有稳定细胞中信使核糖核酸的功能,但帽结合蛋白eIF4E不能识别A-帽结构,因此信使核糖核酸不是帽依赖性翻译的底物。然而,这需要使用RNA报告子,因此使用上述RNA报告子的所有注意事项都适用
四、结论
长期以来,人们一直认为转录水平的变化是蛋白质水平变化的良好预测因子,因此遗传学、癌症和发育生物学的许多研究都将重点放在转录组上,并假设转录组准确反映了基因表达的变化。然而,最近一项比较转录水平和蛋白质水平的研究表明,在哺乳动物中,它们之间没有很好的相关性。这表明我们还没有意识到有助于基因表达的大量转录后调节。
在过去的十年里,越来越多的翻译领域以外的研究人员注意到,他们最喜欢的蛋白质的蛋白质水平发生了变化,而转录物的水平仍然保持不变。这导致越来越多的调查人员询问他们的信息是否受到翻译控制,然后询问它是否有IRES。虽然用于评估IRES活性的双稳态报告基因测定法简单而优雅,但魔鬼就在细节中。这些细节是必须进行的大量仔细控制,以便通过积极排除所有替代方案来建立真正的IRES活动。如果不能进行所需的控制,消除对第二顺反子表达的替代解释,特别是神秘启动子活性、替代剪接位点使用、分流或通读,几乎肯定会导致IRES活性的错误归因。希望这篇综述已经足够清楚地列出了实验和理由,让新手和专家都能可靠地确定RNA元件是否具有真正的IRES活性
参考资料
- So You Want to Know if Your Message Has an IRES? https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3419317/
