【9.3.3】mRNA 去腺苷酸化
稳态 mRNA 水平——以及最终的蛋白质表达——反映了新 mRNA 合成和现有转录本更新之间的平衡。<font color=‘red>在真核生物中,mRNA 的稳定性高度依赖于 poly(A) 尾,这是一长串保护转录物 3’ 端的腺苷残基。去除 poly(A) 尾部,称为去腺苷酸化(deadenylation),是 mRNA 转换的第一步和限速步骤,也是调控的关键点 (Chen and Shyu, 2011)。
在标准视图中,人类 mRNA 上的 poly(A) 尾部最初由 Pan2-Pan3 复合物修剪。在酵母和人类中,剩余的残留物随后被 Ccr4-Not (CNOT) 复合物去除。最初令人惊讶的发现是 CNOT 复合物具有两种核酸酶Caf1 和 Ccr4,这是从酵母到人类的保守特征(Tucker 等,2001 )。 poly(A) 尾部被细胞质poly(A) 结合蛋白Pab1(人类中的 PABPC1)包被,通常认为它可以保护 3' 末端免受死腺苷酸酶的影响。在本期Molecular Cell 中,Webster 等人。(2018)和Yi 等人。(2018) 确定这些因素之间的复杂关系及其在去腺苷酸化中的互补作用。
去腺苷酸化对于基因表达至关重要,这使得分子细节难以在体内重建。为了规避这一点,韦伯斯特等人。(2018)使用来自裂殖酵母Schizosaccharomyces pombe 的模型底物和蛋白质在体外重建脱腺苷酸。出乎意料的是,在重组 Pab1 的存在下,mRNA 去腺苷酸化实际上加速了。进一步的实验表明,Pab1 与 CNOT 物理相互作用,刺激 Ccr4,但强烈抑制 Caf1。这些互补的活动导致 Ccr4(可以从 poly(A) 尾部释放结合的 Pab1)和 Caf1(去除游离的 poly(A))之间的交替活动循环(图1A)。为了验证这些 体外研究结果,韦伯斯特等。(2018)还使用出芽酵母酿酒酵母检测了体内去腺苷酸化。Ccr4 的缺失导致 mRNA 去腺苷酸化缺陷,表明其置换 Pab1 的活性对于大多数 mRNA 的转换至关重要。相比之下,Caf1 缺失几乎没有影响,这可能表明 Ccr4 在一般去腺苷酸化中具有功能冗余。
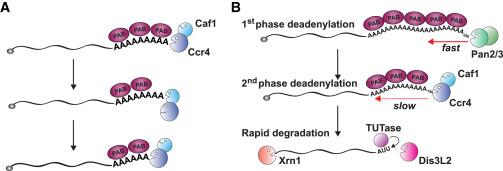
图1。mRNA去腺苷酸化模型
(A) 细胞质去腺苷酸化循环。在人类和酵母中,mRNA 的 poly(A) 尾部最初与多拷贝的poly(A) 结合蛋白(PAB)结合。Ccr4 通过与 PAB 的相互作用而被激活。Ccr4 的降解去除了 PAB 结合位点,从 mRNA 中释放出单体。游离的 3' poly(A) 序列现在是 Ccr4 的不良底物(poor substrate),但对于 Caf1 是理想的。Caf1 的降解去除了游离的 A 尾,但被下一个 PAB 单体抑制。
(B) 双相去腺苷酸化。在人类中,聚 (A) 尾巴因 PAN2/3 活性而迅速缩短至约 150 nt。随后是 Ccr4/Caf1 活动的循环,如 (A) 中所示。短 A 尾可以被人类的末端尿苷转移酶(TUTases)靶向,导致 3’核酸外切酶Dis3L2 的快速 3' 降解或 5' 核酸外切酶 Xrn1 的脱帽和降解。出芽酵母缺乏 TUTases,但 A 尾的缩短也会引发 5' 和 3' 降解。
然而,Caf1 也可能在特定 mRNA 的去腺苷酸化中发挥更特殊的作用。具有次优密码子的转录本翻译不佳且不稳定(Presnyak 等人,2015 年),并且相同的转录本也显示相对于 poly(A) 尾长而言较低的 Pab1 占有率(Webster 等人,2018 年)。这一观察结果本身就令人惊讶,因为通常设想 Pab1 完全覆盖聚 (A) 尾部。有趣的是,具有低 Pab1 结合的 mRNA 优先被 Caf1 靶向,而具有高水平 Pab1 结合的转录本对 Ccr4 更敏感。这些观察结果支持 Pab1 将翻译效率与 mRNA 命运联系起来的模型。
为了分析人体细胞中的体内去腺苷酸化,Yi 等人。(2018)应用了 TAIL-seq ( Chang et al., 2014 ),它通过高通量测序确定 poly(A) 尾长度和组成。他们检查了几种去腺苷酶,包括 CNOT 亚基 CAF1 和CCR4、PAN2/3 和核去腺苷酸酶 PARN。正如在酵母中一样,CNOT 起着关键作用:在 CAF1 耗尽后,几乎所有细胞质 mRNA 都显示出增加的丰度和更长的 poly(A) 尾,这也会导致 CCR4 失活。易等人。(2018)还在体外重组了去腺苷酸化使用纯化的人类成分,结果与酵母中获得的结果非常相似。人 CCR4 的活性严重依赖于聚 (A) 结合蛋白PABPC1 的存在,而 CAF1 仅在缺乏 PABPC1 的尾部有活性。总之,这些特征在去腺苷酸化中产生 27 个核苷酸 (nt) 的周期性,对应于 PABPC1 的单个单体的足迹(图1A)。
在人类细胞中,新合成的 mRNA 具有 200–250 nt 的 poly(A) 尾 ( Kühn et al., 2017 )。在“双相去腺苷酸化”模型(Yamashita 等人,2005 年)中,poly(A) 尾部在两个连续阶段中被去除。最初,mRNA 被 Pan2/3 复合物逐渐去腺苷酸化至 110 nt,此时剩余的残基被 CNOT 迅速去除。建议过渡到第二阶段以触发 mRNA 5' 和 3' 衰变。酵母也提出了类似的两步去腺苷酸化途径(Tucker 等,2001)。
Yi 等人提出的结果。(2018)有助于阐明该模型的各个方面。CNOT 的敲除诱导了约 150 nt 聚 (A) 尾巴的强烈积累,而 PAN2/3 消耗特别增加了超过 150 nt 的尾巴的丰度。有趣的是,野生型细胞中只有一小部分 mRNA 的 poly(A) 尾长超过 150 nt,表明 Pan2/3 的初始去腺苷酸化发生得相当快。与 CNOT 耗竭相反,PAN2/3 对 mRNA 丰度几乎没有影响,这表明去腺苷酸化的第一阶段不是 mRNA 转换的限速步骤,正如之前提出的那样。综上所述,这些观察结果导致了双相去腺苷酸化的修正模型(图 1B)。
每份报告中的一个关键发现是细胞质 poly(A) 结合蛋白在激活去腺苷酸化中发挥的核心作用。这两篇论文都为保护这种违反直觉的特征提供了有趣的可能性。RNA核酸外切酶可能具有混杂的活性,并且可能靶向任何可用的 3' 末端。易等人。(2018)提出 PABPC1 作为看门人,保护 poly(A) 尾部免受过度衰变因素的影响,同时仍然允许 mRNA 通过 Ccr4 的“授权”途径进行转换。为了直接测试这个模型,Yi 等人。(2018 年)检查了寡核苷酸(U)拖尾,它针对去腺苷酸化的 mRNA 进行快速破坏(Morgan 等人,2017 年))。PABPC1 消耗诱导异常高水平的寡尿苷化,即使在长 poly(A) 尾上,支持 PABPC1 防止过早 mRNA 降解的模型(图 1B)。
总之,这些论文基本上阐明了我们对酵母和人类 mRNA 去腺苷酸化的理解。Ccr4 介导的去腺苷酸化似乎是一般 mRNA 转换的关键途径,并且可能是大多数细胞质 mRNA 的默认命运。相比之下,Pan2/3 早期去腺苷酸化的功能重要性仍不清楚。Yi 等人提出的结果(2018)反对在一般 mRNA 转换中的作用,但不排除基因或组织特异性功能。重要的机械细节也仍然不确定。例如,一旦 poly(A) 尾巴达到特定长度,Pan2/3 如何“知道”停止修剪,以及去腺苷酸化循环如何与物种特异性 mRNA 衰减率相关联?这些问题对未来的研究提出了挑战。
参考资料
- https://www.sciencedirect.com/science/article/pii/S1097276518304519。Volume 70, Issue 6, 21 June 2018, Pages 987-988,Tailing Off: PABP and CNOT Generate Cycles of mRNA Deadenylation
