【9.4.1】dsRNA--了解和克服合成 mRNA 的免疫反应
信使 RNA (mRNA) 是将 DNA 中编码的遗传信息传递给细胞的蛋白质合成机制的中间分子。由于其表达的短暂性和 mRNA 技术的进步,包括对 mRNA 的修饰和对递送载体的改进,mRNA 正在被探索为各种治疗方法(例如,免疫肿瘤学、疫苗、蛋白质替代疗法和基因组编辑药物)。该方法的简单性,即在体外合成类似于内源性 mRNA 并编码目标蛋白质的 mRNA,然后在体外或体内递送和表达,使其具有吸引力并具有广泛的适用性。
将体外转录的 RNA 用作治疗剂需要大量具有低免疫原性的功能性 RNA。用于合成这些体外转录 mRNA 的技术——主要是使用 T7 噬菌体 RNA 聚合酶 (T7 RNAP)——已经得到很好的证实。T7 RNAP 从包含噬菌体酶特异性启动子的 DNA 模板中高保真地转录 RNA。虽然使用 T7 RNAP 从 DNA 模板合成 RNA 的过程是稳健的,但之前的研究已经确定了体外合成过程中某些会引发细胞免疫反应的副产物的存在,包括双链 RNA (dsRNA),这已被证明成为免疫通路的主要触发因素。
因此,在为寻求最小化细胞免疫反应的体内应用合成 mRNA 时,从 mRNA 制剂中消除这些 dsRNA 污染物或减少它们的形成至关重要。
一、这些 dsRNA 副产物是什么?
dsRNA 副产物的产生被认为主要通过两种不同的机制发生。
首先,由 T7 RNAP 合成的 RNA 转录物(径流转录物,runoff transcript,图 1)作为 T7 RNAP 在随后几轮转录中的 RNA 依赖性 RNA 聚合酶活性的模板。如果径流转录本的 3' 端具有足够的互补性(顺式),它将向后折叠并导致径流转录本的延伸。生成的 RNA 将在 3' 末端延伸,并且可以在凝胶上的变性条件下与主要转录物区分开来(图 2A)。

图 1. 体外转录过程中 dsRNA 副产物形成的可能机制的示意图
短的 RNA 片段,例如无效的转录本,可以与径流转录本(runoff transcript)(反式)中的互补序列退火,并且还会导致 dsRNA 副产物的形成(图 1B)。dsRNA 产物的特性和性质将根据延伸是以顺式还是反式发生而有所不同,并且预计在 RNA 积累和伪产物(spurious products)形成之间存在很强的相关性,因为合成的 RNA 可能会重新结合聚合酶以启动延伸.
为形成 dsRNA 副产物提出的第二种机制假定 RNAP 可能转换为非模板链,从而产生与径流产物互补但以独立于启动子的方式合成的 RNA 分子(图 1C)。因为反义分子的大小与径流产物的大小相似,所以不能通过变性凝胶电泳区分。相反,由于反义 RNA 分子的存在而形成的 dsRNA 副产物的分析将需要天然条件(图 2B)。
二、如何检测反应中的 dsRNA 副产物?
用于检测体外转录 (IVT) 反应中 dsRNA 副产物的最突出工具之一是基于免疫印迹的测定,它依赖于与 dsRNA 特异性抗体反应中副产物的识别。这种类型的测定已用于许多不同的 RNA 序列,是 IVT 反应中 dsRNA 副产物存在/不存在的良好指标(图 2C)。然而,用这种方法很难准确量化反应中 dsRNA 的数量。还有其他检测方法可以量化 IVT 反应中的 dsRNA 副产物。
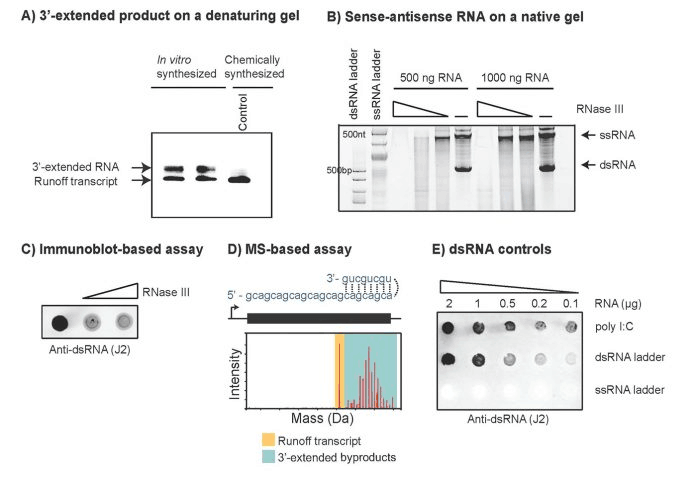
图 2. 检测 dsRNA 副产物的方法。(A) 变性凝胶电泳可用于分离和检测 3'-末端延伸的 dsRNA 副产物。(B) 天然凝胶电泳检测有义-反义 dsRNA 副产物。(C) 抗 dsRNA (J2) 抗体可识别长段 dsRNA 区域(> 40 个碱基对),因此可用于长 RNA 转录。RNase III 用作对照,因为它优先降解 dsRNA。(D) 完整质谱可用于量化 IVT 反应中产生的不同 3'-末端扩展 dsRNA 物种的丰度和长度。(E) dsRNA 的控制。
定性和定量分析都依赖于抗体对 dsRNA 副产物的识别,区分真正的 dsRNA 副产物和 RNA 中的内在二级结构可能是这些基于抗体的分析的一个问题。此外,在使用修饰的 mRNA 时需要进行仔细研究,因为修饰的存在也会改变抗体对 dsRNA 结构的识别。
dsRNA 介导的免疫反应被认为是部分通过 dsRNA 与胞质免疫受体 MDA5 的结合来介导的。MDA5 是一种 ATP 依赖性解旋酶,MDA5 与 dsRNA 副产物的结合导致 ATP 水解,这可以通过标准生化分析进行测量。MDA5-dsRNA 的冷冻电子显微镜 (cryo-EM) 结构显示存在细丝(filaments),对这些细丝结构的分析表明,每个 MDA5 分子跨越 14 或 15 个 RNA 碱基对。然而,能够进行此类冷冻电镜分析的设施的使用可能会受到限制;因此,在存在 MDA5 的情况下进行 ATP 水解的体外测定可以成为了解将从感兴趣的 mRNA 产生的免疫反应程度的良好替代方法。
为了更好地了解 dsRNA 副产物的确切序列和性质,可以进行 RNA-seq 和完整质谱分析(图 2D)。然而,RNA-seq 实验中针对(或可能针对)结构化 RNA 的连接偏差可能会影响这些比较。RNA 3' 端的完整质谱分析不会提供序列信息,但会提供所选 RNA 中看到的异质性分布。然而,这些方法可能并非所有人都可以轻易获得,并且无法以高通量方式进行,尤其是在筛选大量序列时。
在设置检测时,应使用正确的对照以确保检测灵敏度最佳。合成 RNA(有/无修改)或其他具有成本效益的控制,例如来自新英格兰生物实验室的 dsRNA 梯子和合成聚(I:C),可用于确保该测定识别 dsRNA 物种(图 2E)。使用基于抗体的检测时,必须牢记抗体的检测取决于 dsRNA 区域的长度,并且可能需要调整检测的灵敏度以确保检测可以检测到这些 dsRNA 副产物.
由于免疫分析无法区分 dsRNA 产物是由于 3' 端延伸或反义分子合成而形成的,因此建议实施一种以上的方法来表征副产物的性质,因为了解分子的性质可以指导采取哪种方法来防止在 IVT 反应中形成 dsRNA 副产物(见下一节)。
三、如何减少 IVT 反应中 dsRNA 副产物的形成?
已经描述了几种方法来规避在 IVT 反应中产生的 dsRNA 副产物的影响。许多这些方法依赖于在 IVT 反应完成后去除副产物,分析纯化是最主要的方法。由于 dsRNA 副产物不易与主要 IVT RNA 产物区分开来,因此无法通过大小排阻色谱法将它们分开,后者用于去除其他污染物或副产物,例如无效转录物。然而,广泛的基于离子对反相高效液相色谱 (HPLC) 的纯化已被证明可以将 dsRNA 副产品与主要 IVT RNA 产品分开(图 3A)。

图 3. IVT 反应中 dsRNA 副产物的减少。(A) 高效液相色谱 (HPLC) 纯化,将径流 RNA 产品 (II) 与 dsRNA 污染 (III) 分离。(B) 使用热稳定 RNA 聚合酶在较高温度 (>48ºC) 下进行体外转录可减少 3' 端延伸的 dsRNA 副产物形成,如多种检测方法所见。
HPLC 纯化过程中 dsRNA 副产品的较长保留时间表明该方法可用于将 3'-扩展的 dsRNA 副产品与主要 IVT RNA 分离。虽然有效,但这种方法会导致 mRNA 合成工作流程中的一个额外步骤,涉及专门的仪器,与放大反应不兼容,并且阻碍了该方法的成本效益。
此外,尚不清楚这种基于 HPLC 的方法是否可以有效地分离反义 dsRNA 产物,它们的分离可能取决于所使用的实验条件。还报道了一种基于 dsRNA 污染物去除的基于纤维素的色谱方法,该方法基于 dsRNA 与纤维素的选择性结合。尽管这种纯化策略具有成本效益,并且这种方法的一次性性质可以防止先前纯化的遗留物,但它可能并不适用于所有 mRNA 序列,因为某些 mRNA 可能具有更高的形成二级结构的倾向这可能会降低恢复速度。
合成后纯化的替代方法是通过改变 IVT 反应条件来防止在 IVT 反应中形成 dsRNA 副产物。已建议降低 IVT 反应中的镁含量以减少一些特定模板2的 dsRNA 副产物(由反义 RNA 的合成形成)的形成;然而,降低反应中的镁浓度也会影响 RNA 的总产量,这对于需要大量 mRNA 的应用来说是不可取的。
最近已经表明,添加与径流转录物 3'-末端互补的 DNA 寡核苷酸也可以防止 3'-延伸的 dsRNA 副产物的形成,但在合成治疗性 mRNA 后去除这种寡核苷酸可能具有挑战性并且需要额外的酶促步骤,这在尝试简化工作流程和限制生产成本时是不可取的。
使用热稳定RNA聚合酶,如HiT7的®自New England Biolabs,已经显示出降低3'-延伸的dsRNA的副产物(形成图3B在IVT反应)而不影响总产率或的完整性RNA,它不需要额外的酶处理,这可以为当前的 IVT 反应工作流程提供替代方案。
最适合去除/预防 dsRNA 污染物的方法将取决于最终应用和所需的 RNA 产量规模。对于放大是先决条件的应用,合成后的纯化步骤可能会阻碍最终结果。更好的方法是防止在合成过程中形成 dsRNA 副产物。
四、未来展望
使用合成的 mRNA 作为药物需要 mRNA 没有任何污染的 RNA,并且需要大量合成。因此,在选择合适的方法去除dsRNA副产物以合成您最喜欢的mRNA分子时,应尽早考虑IVT反应的最终应用和规模。从感兴趣的序列(3'-扩展与反义)合成的 dsRNA 副产物的性质也将是决定减少 dsRNA 生成的方法对给定模板更有效的一个因素。例如,模板编码的 poly-A 拖尾可以避免形成一些 dsRNA 副产物,但不是全部,高温转录可以减少 3'-末端延伸的 dsRNA 副产物,但不能减少反义 RNA 的合成。对于需要放大的应用,使用高产率反应条件合成更大量的 RNA 很有吸引力。然而,由于在存在过量 RNA 的情况下可以增强一些 dsRNA 副产物的形成,因此应考虑酶:模板:NTP 条件并针对每个序列进行优化,以最大限度地减少这些 dsRNA 副产物的形成。DNA 模板或 RNA 分子中更容易形成 dsRNA 副产物的序列的性质尚不完全清楚。
更好地了解序列特异性有助于合理设计 mRNA 3'-末端,以防止在反应中形成这些污染物。即使模板序列和/或反应条件的微小变化也可能影响 dsRNA 副产物形成的程度,在设计/修改模板序列时应予以考虑。最后,在使用修饰的 NTP 制作 mRNA 时,检测 dsRNA 副产品可能很困难,在这种情况下,至少应实施一种以上的方法来表征和定量 dsRNA 副产品。
总之,用于治疗目的的合成 mRNA 的高效且具有成本效益的生产将需要对最终 mRNA 产品的性质有透彻的了解,并且将取决于最大限度地减少污染物产生的合成过程,否则将需要昂贵的纯化方法。
参考资料
