【9.4.2】RNA特异性Toll样受体对健康和疾病的影响(TLR)
RNA 感应 Toll 样受体 (TLR,Toll-like receptors) 通常被描述为先天免疫系统的抗病毒受体。然而,过去十年表明,这些受体的功能和相关性要复杂得多。它们被发现对于检测各种细菌、古细菌和真核微生物至关重要,并有助于区分死微生物和活微生物。触发的细胞因子和干扰素反应谱有可能提高下一代疫苗的功效,并可能预防哮喘和过敏(asthma and allergy)的发展。然而,识别外来 RNA 的能力是有代价的,因为受损的宿主细胞也会释放可能诱导不适当免疫反应的核酸。因此,RNA 感应 TLR 在各种自身免疫疾病中发挥关键作用也就不足为奇了。
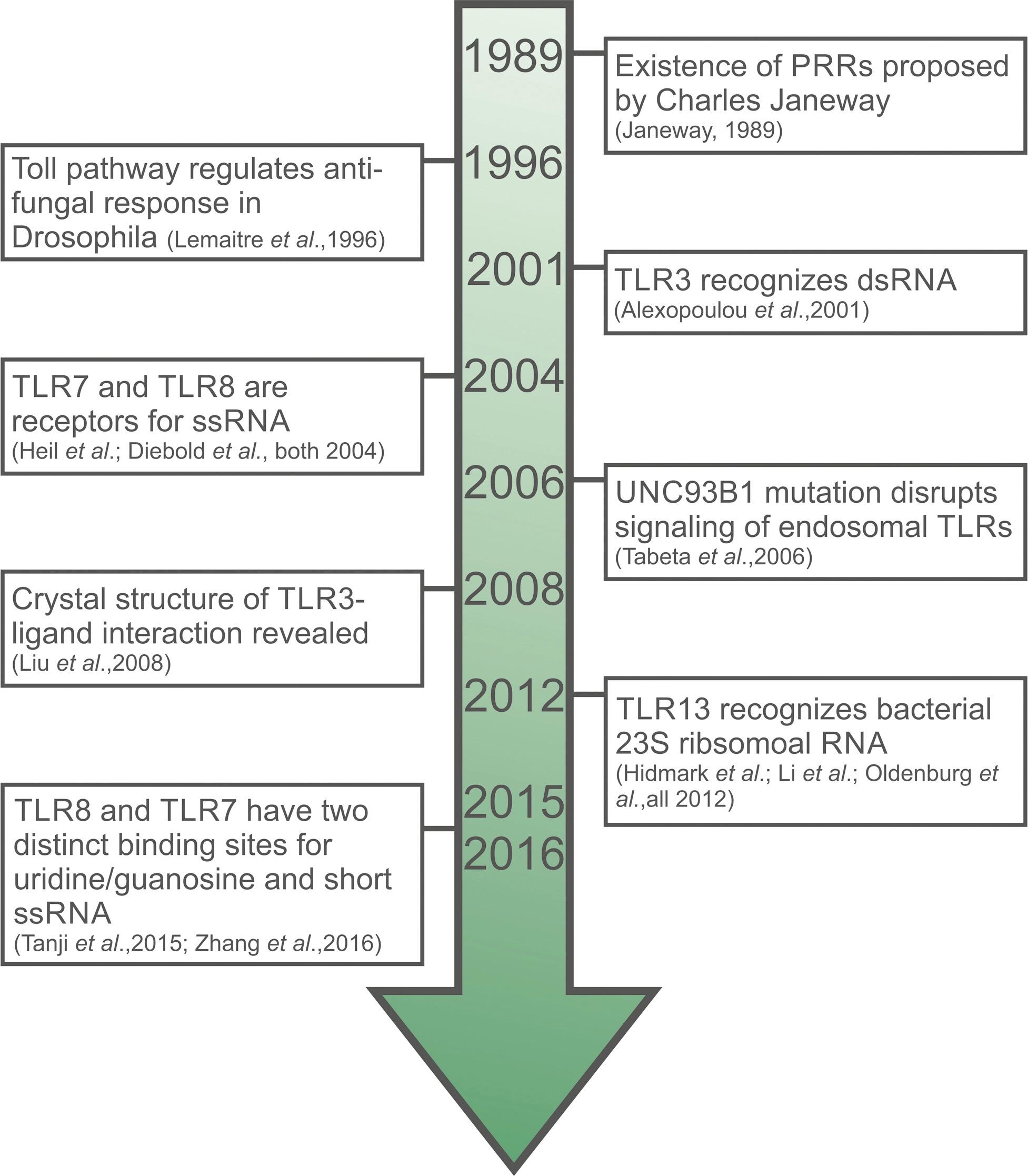 重大里程碑发现
重大里程碑发现
1.介绍
先天免疫系统是保护身体免受微生物入侵的第一道防线。为了区分自我和非自我,该系统开发了广泛的不同受体,称为模式识别受体 (PRR, pattern recognition receptors ),它们识别保守的微生物结构,即所谓的病原体相关分子模式 (PAMP, pathogen-associated molecular patterns)。许多 PAMP 对微生物具有特异性,包括细菌细胞壁成分,如脂多糖 (LPS) 或肽聚糖,并且不是由宿主细胞产生的。由于这些结构不仅限于病原体,而且与许多微生物有关,因此它们也被称为微生物相关分子模式 (MAMP,microbe-associated molecular patterns)。核酸 (NAs) 是所有生物体的基本结构成分,它们的识别极大地扩展了免疫系统检测外来入侵者的能力。与许多其他 MAMP 相比,NA 不仅由微生物产生,也由宿主本身产生。然而,宿主有不同的机制来防止由其自身的 NA 诱导的意外免疫反应。例如,NA 修饰或受体和配体的差异细胞定位会阻碍受体激活。例如,受损的宿主细胞可以释放可能诱导免疫反应的 NA,这就是为什么它们可以另外归类为危险相关分子模式 (DAMP)。如果内源性 NAs 在没有急性危险或损害的情况下触发免疫反应,它们的检测会增加自身免疫和无菌炎症的风险。通过细胞核酸酶(如 RNase H2 或 TREX1)的突变清除 NA 的缺陷可导致 NA 的积累,并最终导致不需要的免疫反应。涉及识别内源性 NA 的自身免疫性疾病包括系统性红斑狼疮 (SLE) 和 I 型干扰素病。尽管如此,NA 特异性受体已被证明在针对各种不同病原体(包括细菌、病毒和原生动物)的免疫反应中发挥着至关重要的作用。这些受体是 I 型干扰素 (IFN) 反应的有效诱导剂,但它们也可以触发促炎细胞因子的分泌,如肿瘤坏死因子 (TNF) 和白细胞介素 1 β (IL-1β),具体取决于受体类型. 原则上,NA 特定的 PRR 可以分为两个子类:
- 一组包括位于内体和溶酶体膜上的 Toll 样受体 (TLR)
- 另一组包括来自不同受体家族的细胞质受体。
在人类中,存在 10 种不同的 TLR,位于细胞表面或内体,而在小鼠中已知有 12 种 TLR。TLRs 识别细菌细胞壁成分,如 LPS 或脂肽,蛋白质如鞭毛蛋白或 profillin 以及不同的 NA 物种。所有 TLR 共享一个共同的结构,包括一个称为 Toll-IL-1-resistance (TIR) 域的胞质域,该域对信号转导很重要,一个跨膜域 (TM) 和一个包含富含亮氨酸重复序列 (LRR) 的胞外域形成一个典型的马蹄形结构。胞外域解释了配体特异性和结合。人内体 TLR 包含 TLR3 和 TLR7-9,而小鼠还表达 TLR13。TLR3 识别双链 RNA (dsRNA) 并利用包含接头分子 TIR 结构域的接头诱导 IFN-β(TRIF,也称为 TICAM1),而 TLR7-9 和 TLR13 的信号转导依赖于骨髓分化初级反应 88 (MyD88)。人TLR7和TLR8两者识别单链RNA(ssRNA),和TLR9特异性针对未甲基化CpG DNA。最近发现的 NA 感应 TLR 是 TLR13,它识别细菌 23S 核糖体 RNA (rRNA) 中的特定序列。(图 1) 配体结合后,TLR 启动信号级联反应,导致各种转录因子的核易位。一个主要的转录因子是活化 B 细胞的核因子 kappa-轻链增强子 (NF-κB),它诱导促炎细胞因子,如 IL-6 和 TNF。根据受体,干扰素调节因子 (IRF) 的某些子集,例如 IRF3、IRF5 或 IRF7,被激活并诱导 I 型 IFN 反应,包括 IFN-α 和 IFN-β。
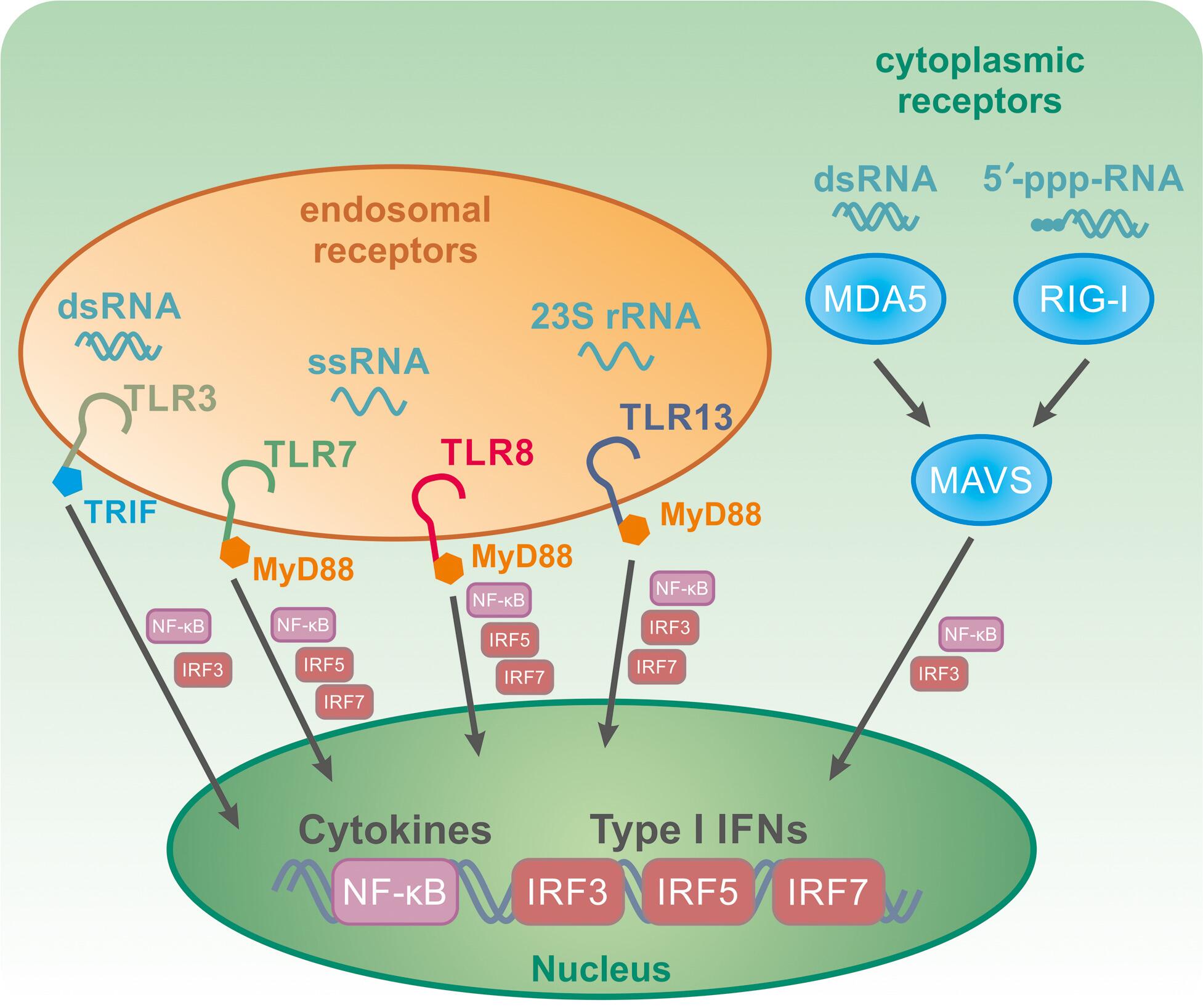
图1 主要的 RNA 感应先天免疫受体。RNA 感应受体的不同之处在于它们的细胞位置(内体或细胞质)和它们的配体特异性。Toll 样受体 (TLR) 3、7、8 和 13 位于内体中,并与 dsRNA (TLR3)、ssRNA(TLR7 和 TLR8)或细菌 23S rRNA 中的特定序列(TLR13,仅在啮齿动物中)结合. TLR3 的信号转导依赖于接头蛋白 TRIF、TLR7/8 和 TLR13 通过 MyD88 发出的信号。TLR 激活导致转录因子 NF-κB 和特定 IRF 子集的核易位,以诱导特定子集细胞因子和 IFN 的产生。重要的细胞质 RNA 特异性受体是结合 dsRNA 的 MDA5 和结合 5'-三磷酸 RNA 的 RIG-I。MDA5 和 RIG-I 都在配体结合后通过衔接蛋白 MAVS 发出信号。
重要的细胞质 RNA 受体是视黄酸诱导基因 I (RIG-I,retinoic acid-inducible gene I )、黑色素瘤分化相关蛋白 5 (MDA5, melanoma differentiation-associated protein 5) 和遗传学和生理学实验室 2 (laboratory of genetics and physiology 2,LGP2,也称为 DHX58),它们都属于RIG-I 样受体 (RLR,RIG-I-like receptors)。RIG-I 和 MDA5 的配体分别是 5'-三磷酸 RNA 和(长)dsRNA(图 1),而对 LGP2 的天然配体知之甚少。尽管显示 LGP2 具有结合 RNA 的能力,但它被认为对 RIG-I 和 MDA5 具有相当的调节功能。线粒体抗病毒信号蛋白 (MAVS,Mitochondrial antiviral signaling protein) 对 RLR 功能至关重要,因为它在 RLR 接合后聚集在线粒体膜上并激活 IRF3 以诱导抗病毒反应。胞质溶胶中的外来和宿主来源的 DNA 由环 GMP-AMP 合成酶 (cGAS) 检测,该酶通过第二信使 2',3'-环 GMP-AMP (cGAMP) 激活干扰素基因刺激物 (STING)。在黑色素瘤2(AIM2)的缺席和γ-干扰素诱导蛋白(IFI16)25个inflammasomes由双链DNA也被激活,而来自细菌,各种不同的NA物种如RNA 个病毒,和古细菌,以及RNA:DNA杂交体,和氧化的线粒体DNA 激活 NLR 家族含有 pyrin 结构域的 3 (NLRP3) 炎症小体。炎症小体激活导致 caspase-1 成熟,caspase-1 是一种将炎症细胞因子 pro-IL-1β 和 pro-IL-18 转化为其活性形式的酶。
本综述重点关注 RNA 传感 TLR,特别强调最近发现的受体结构、它们在检测不同细菌和病毒以及古细菌中的作用,以及它们与疾病发展和疫苗接种的相关性。
2. RNA特异性TLRS的结构和配体特异性
所有 RNA 感应 TLR 都位于内体区室中,TIR 结构域面向细胞质。最近关于 RNA 传感 TLR 结构的报告提高了我们对配体结合如何发生以及如何实现特异性的理解。尽管没有任何全长 TLR 的晶体结构可用,但所有 RNA 传感 TLR 的配体结合 LRR 结构域的结构已经解决。
未配体 TLR3 的晶体结构表明受体以单体形式存在。单个 dsRNA 分子与两个受体结合,导致受体二聚化并形成活性信号复合物。TLR3 在胞外域的相对末端包含两个结合位点,结合是通过 LRR 结构域中带正电荷的残基与核糖-磷酸骨架之间的静电相互作用实现的,与 RNA 序列无关。可被 TLR3 识别并诱导信号转导的 dsRNA 的最小长度约为 40-50 bp(图 2)。因此,由于双链片段也存在于各种内源性 RNA 物种(例如转移 RNA (tRNA) 或 rRNA)的二级结构中,因此细胞可以通过短 dsRNA 免受无意的 TLR3 激活。TLR3 的蛋白水解加工对其稳定性和细胞内运输至内体区室很重要。TLR3 主要由髓样树突细胞 (mDC) 和成纤维细胞表达,但也存在于包括肺和肠道在内的多种组织的上皮细胞中。(表 1)。
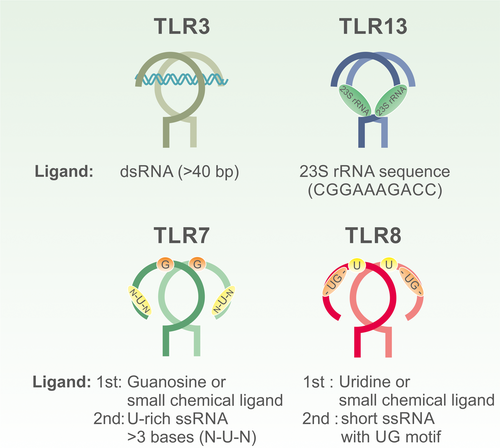


人类 TLR7 和 TLR8 两者都是密切相关的受体,并由 ssRNA 和小化学配体(如瑞喹莫特 (R848) 或 CL097)激活。这些受体共享一个结构特征,称为 Z 环,这是一个约 30 个氨基酸的区域,位于 LRR14 和 LRR15 之间。内体中 Z 环的裂解对于受体功能和信号转导来说是必需的——在此之前,受体保持不活跃。由于胞外域中的五个氨基酸缺失,ssRNA 或其他 TLR7/8 激动剂无法触发鼠 TLR8 (mTLR8)。尽管 mTLR8 经常被描述为无功能,但咪唑喹啉和寡脱氧核苷酸 (ODN) 的组合可以激活受体。此外,TLR8 -/-小鼠出现自身免疫症状,而TLR7 -/-和TLR7 -/- TLR8 -/-没有,表明mTLR8具有调节功能。由于鼠和人受体之间存在明显差异,以下 TLR8 指的是人类形式。
虽然过去的一些研究表明 TLR7 或 TLR8 识别特定的 RNA 序列,但晶体结构表明这两种受体都识别 ssRNA 的降解产物,而不是特定的序列。TLR7 和 TLR8 都有两个不同的结合位点。第一个位点是单个核苷的特异性位点,它们分别是 TLR7 和 TLR8 的鸟苷和尿苷,位于二聚化界面(图 2)。在 TLR7 的情况下,鸟苷的衍生物,例如脱氧鸟苷和 8-羟基鸟苷,也能够在第一个位点结合。TLR7 晶体结构的分析表明,第二个位点识别短且富含 U 的 3 聚体寡核糖核苷酸 (ORN),例如 3 聚体 UUU。中间位置的 U 是强制性的,而其他位置则更灵活。占据第一个位点诱导受体二聚化和弱激活,而第二个位点的 ORN 的额外结合协同增强二聚化过程和信号转导。
另一方面,未配体的 TLR8 已经以二聚化但无活性的形式存在,它在配体结合时被激活。TLR8 的第 2 个位点对包含至少两个核苷酸的 ORN 具有特异性,并且具有 UG 基序或广义上的 UR/URR 基序。晶体结构还有助于了解小型合成配体(如 R848、CL075 或 CL097)如何在不存在 ssRNA 的情况下激活受体。这些小分子化合物与第一个结合位点结合,与天然核苷相比具有更高的结合亲和力,足以激活受体而不占用第二个位点。参与将 ssRNA 降解为能够激活 TLR7 和 TLR8 的核苷和短 ORN 的核酸酶和磷酸酶尚未确定。尽管这两种受体在结构和配体特异性方面密切相关,但它们在人类细胞类型特异性表达方面有所不同。TLR7 主要在浆细胞样 DC (pDC) 和 B 细胞中表达,而 TLR8 可以在巨噬细胞 (MΦ) 和单核细胞衍生的 DC (moDC) 中找到。两种受体都存在于偏向 TLR8 的单核细胞中。(表 1 )。
鼠 TLR13 的配体结合与 TLR7/8 的配体结合大不相同,因为它只有一个结合位点,该位点特异性识别革兰氏阳性菌和革兰氏阴性菌的 23S rRNA(“CGGAAAGACC”)中的保守序列。 有趣的是,该核糖体序列是几种抗生素(大环内酯类、林可酰胺类和链霉菌素组)的结合位点,该序列的甲基化不仅会导致抗生素抗性,还会取消 TLR13 的识别。Song 等人对 TLR13-配体相互作用的结构分析 已经证明 TLR13 确实识别 23S rRNA,这与它在核糖体中的天然结构不同,这表明需要 rRNA 的内体降解。
所有内体 TLR 的功能都依赖于一种称为 UNC93 同系物 B1 (UNC93B1) 的伴侣蛋白,正如 Tabeta 等人所表明的那样,在 UNC93B1 中具有错义突变(称为“3d”突变)的小鼠不再对配体作出反应特异于内体 TLRs 和 TLR5,而表面上的所有其他 TLRs 保持功能。UNC93B1 与内体 TLR 的跨膜结构域相互作用,并被认为将它们从内质网 (ER) 通过高尔基体引导至内体并保持与受体相关联,直到到达目标位置。然而,这种 UNC93B1 模型受到 Eike Latz 小组最近的一项研究的挑战,该研究表明 UNC93B1 在贩运过程的上游起作用。NA 感应 TLR 在表达具有 ER 保留基序的 UNC93B1 修饰版本的细胞中仍然起作用。作者证明,UNC93B1 不需要将受体从高尔基体引导至内体,而是需要稳定 ER 中的 TLR 并保护它们免于降解。
3、 RNA-SENSING TLRS 在检测病毒、细菌和古细菌中的作用
NAs 的检测,尤其是 RNA,通常被描述为检测病毒的先天免疫机制。事实上,病毒衍生的 RNA 是最早描述的用于 RNA 传感 TLR 的天然配体之一。例如,TLR3 已被描述为检测鼻病毒,和 TLR7 识别 RNA 病毒流感病毒、水泡性口炎病毒、和柯萨奇 B 病毒。最近的研究表明,特别是人类 TLR8 是检测各种病原菌的重要受体。伯氏疏螺旋体,莱姆病的病原体,被人类 pDC 中的 TLR7 识别并诱导 I 型和 III 型干扰素的分泌。然而,在人类单核细胞中,TLR8 负责检测这种病原体。以后,它被证明Eigenbrod,等人,从RNA转染化脓性链球菌到人类单核细胞和MΦ导致它们的活化和促炎细胞因子如IL-6,TNF以及IFN-β的分泌。此外,在人单核细胞衍生的 MΦ 中用 siRNA 敲低 TLR8 使细胞对化脓性链球菌感染的反应显着降低。观察结果支持化脓链球菌的识别过程由人类吞噬细胞依赖吞噬作用、溶酶体酸化和分子 UNC93B1。其他研究表明,来自金黄色葡萄球菌的RNA 也可被 TLR8 检测到,并在 IRF5 依赖性途径中诱导 IFN-β 的分泌。以类似的方式,无乳链球菌(B 组链球菌)也通过人类单核细胞和 MΦ 中的转录因子 IRF5 诱导 TNF、IL-12p35 和 IFN-β。这些研究表明,TLR8 是各种不同细菌病原体的重要受体。除了促炎细胞因子如 IL-6 和 TNF 外,TLR8 的激活还以分泌 IFN 和 IL-12 为特征。干扰素不仅是有效的抗病毒剂,而且已被证明可有效预防结核分枝杆菌74或肺炎链球菌。此外,IL-12 触发幼稚 CD4 + T 细胞极化为 T H 1 和 T 滤泡辅助细胞 (T FH ) 细胞。因此,TLR8 激动剂可用于加强和调节免疫系统,作为疫苗开发的佐剂,如本综述的单独章节所述。
除了 TLR3、TLR7 和 TLR8 在检测病毒和细菌中的作用外,我们小组最近刚刚确定了另一组通过其 RNA 识别的微生物——古细菌。基于 16S rRNA 分析,Carl Woese 于 1977 年将古细菌确定为自己的原核结构域。尽管古细菌通常与细菌具有相似的形态,但它们在许多方面存在差异,包括核糖体、膜脂结构和DNA复制机制。事实上,古细菌与真核生物密切相关,最近发现的 Lokiarchaeota 门加强了真核生物是从一个共同的古细菌祖先进化而来的假设。几项研究表明,古细菌是人类微生物群的重要组成部分,可以在微生物定植的每个表面上找到。到目前为止,还没有发现任何致病古菌物种,尽管它们的潜在存在已经讨论了十多年。然而,有人提出古细菌在牙周炎、炎症性肠病 (IBD)、或气道炎症等炎症性疾病中的作用。产甲烷古菌Methanosphaera stadtmanae在人外周血单核细胞 (PBMC) 中诱导强烈的炎症反应和 moDC。虽然对 PRR 的功能及其各自的细菌配体有足够的了解,但如何检测古细菌,特别是M. stadtmanae的分子机制仍然难以捉摸。我们最近可以证明M. stadtmanae通过其 RNA 被 TLR8 识别,并在较小程度上被 TLR7 识别(图 3)。吞噬作用和溶酶体酸化是 TLR7 和 TLR8 进入古菌 RNA 所必需的。M. stadtmanae诱导促炎细胞因子,如 IL-1β、IL-6 和 TNF 以及 I 型和 III 型干扰素。此外,M. stadtmanae以 TLR8 依赖性方式激活 NLRP3 炎症小体,类似于人单核细胞中 LPS 诱导的替代炎症小体激活过程。依赖于 TLR8 的替代激活不会导致 ASC 斑点的形成,不依赖于钾外流,并且仅部分依赖于蛋白质 NIMA 相关激酶 7 (NEK7),这是规范激活所必需的。NLRP3的TLR8介导的激活也被用于在人单核细胞的人免疫缺陷病毒(HIV)感染所描述 ; 然而,确切的机制和信号通路仍有待确定。

图3 人类吞噬细胞中古细菌Methanosphaera stadtmanae 的 TLR8依赖性识别。M. stadtmanae通过吞噬作用被骨髓免疫细胞吸收。在吞噬溶酶体内部,古细菌被降解,并释放出古细菌 RNA。然后 TLR7 和 TLR8 可以识别 RNA,并诱导信号级联反应,导致转录因子 IRF5 和 NF-κB 的激活和核易位。因此,诱导了 I 型和 III 型干扰素以及促炎细胞因子的表达。通过一种未知的机制,TLR8 还激活了 NLRP3 炎症小体。该过程导致 caspase-1 的激活,caspase-1 反过来将 pro-IL-1β 加工成其活性形式。与典型的炎症小体激活相反,钾外流不是M. stadtmanae诱导的炎症小体激活的特征,而 NEK7 仅部分参与
4 微生物 RNA 在疫苗开发中的作用
减毒活疫苗挽救了无数生命,并有助于根除或控制严重的传染病,如天花、麻疹或脊髓灰质炎。活疫苗的优点包括更容易应用(例如,口服或鼻腔)、长期保护,并且加强注射通常是不必要的。但是,与死去的微生物相比,是什么让活的微生物更有效?免疫系统如何区分活疫苗和灭活疫苗?答案是所谓的与活力相关的 PAMP(vita-PAMP)——仅存在于活体中而不存在于死或灭活生物体中的分子结构。 最早描述的 vita-PAMP 之一是细菌信使 RNA (mRNA),它是所有活微生物的重要组成部分,可显着增强小鼠的体液反应。先天免疫受体检测 vita-PAMPs 不仅限于致病菌,还用于检测非致病菌。此外,RNA 和灭活细菌的共同给药能够将免疫激活和抗体滴度恢复到与活细菌相似的水平,主要是通过以 TRIF 依赖性方式诱导 IFN-β 和 IL-1β。这是最近刚刚通过Barbet的示出,这两个细胞因子是为T的发展的重要FH细胞在鼠系统与活细菌接种后。Ť FH细胞为 B 细胞发育、亲和力成熟和记忆 B 细胞的形成提供帮助,这就是为什么这种细胞类型对于建立针对传染性病原体的持久保护非常重要。然而,人类的情况与小鼠不同,因为 IL-12 和 IL-23 对于从幼稚 CD4 + T 细胞发育人类 T FH细胞非常重要。乌戈利尼,等人证实活大肠杆菌但不是热灭活大肠杆菌诱导IL-12的分泌在人和猪单核细胞,其随后导致T的产生FH细胞(图 4A)。活细菌的 IL-12 诱导作用是通过单核细胞中的 TLR8 检测 RNA 来介导的。此外,作者通过用活的和热灭活的鼠伤寒沙门氏菌血清型对猪进行疫苗接种证实了体外研究结果,其中活疫苗接种诱导了显着增强的体液反应。值得注意的是,人类和猪的免疫系统密切相关,并在这两个物种TLR8为的ssRNA的功能性受体这是不是在鼠系统的情况。因此,靶向 TLR8 的微生物 RNA 可作为激活和增强免疫系统的有效佐剂。vita-PAMPs 作为活疫苗接种中微生物活力的标志的作用可以被合成的 TLR8 激动剂替代,例如 CL075,这可以克服活疫苗的安全问题。TLR7/8 配体作为有效佐剂的功效已经在包括非人类灵长类动物在内的不同实验设置中得到证实。有趣的是,古细菌M. stadtmanae被仅依赖 TLR8 和 TLR7 的先天免疫系统识别,显然没有任何其他先天免疫受体的参与。考虑到这一天没有致病古菌已被确定和古脂类已经被证明持有佐剂活性,事实古菌的使用,如M. stadtmanae,目标TLR8疫苗研制可以考虑。总体而言,针对 TLR8 的微生物 RNA 和小分子化合物是新开发的佐剂的有希望的候选者。它们通过模拟 vita-PAMP 直接激活抗原呈递细胞 (APC) 的能力提供了建立强大而持久的免疫反应的能力,并可能在未来提高疫苗效力。

图 4 TLR8 在乳酸乳球菌T FH分化和过敏保护中的作用。A,活微生物通过促进 T FH细胞分化来增强体液反应。单核细胞(或一般的 APC)中的 TLR8 识别活细菌的 RNA 会导致各种细胞因子的分泌。与不与 TLR8 结合的热灭活细菌相反,细胞因子 IL-12 被诱导,这对于 T FH细胞与人类和猪的幼稚 CD4 + T 细胞的分化很重要。 B、牛舍细菌L. lactisG121 具有由人类 TLR8 或小鼠 TLR13 介导的过敏保护作用。这些受体在 DC 中的参与导致 IL-12 的分泌,从而将 T 细胞平衡从过敏性 T H 2 细胞转变为 T H 1 免疫
5 过敏和哮喘
过敏症是一种沉重的全球经济负担,其患病率急剧增加,尤其是在低收入和中等收入国家。此外,包括哮喘在内的过敏性疾病的复杂性和严重性不断增加,尤其是在儿童和年轻人中。世界卫生组织 (WHO) 报告哮喘患者数量为 3 亿,预计到 2025 年将增加至 4 亿。迄今为止,哮喘无法治愈;然而,为了改善患者的生活质量,以及更重要的是,首先要预防疾病,做出了巨大的科学和临床努力。
哮喘的主要病理生理特征是过敏原诱导的 2 型免疫的结果,其中 T H 2 细胞的极化起着核心作用。这些细胞会释放多种细胞因子,例如 IL-4、IL-5 和 IL-13,这些细胞因子具有炎症性、吸引嗜酸性粒细胞并能够诱导气道重塑。此外,它们刺激 B 细胞成为产生免疫球蛋白 E (IgE) 的浆细胞。T H 2 细胞可以被 IFN-γ 有效地反调节,IFN-γ 是一种由 T H 1 细胞大量释放的细胞因子,T H 1 细胞是 1 型免疫的核心参与者。DCs 可以通过细胞因子和 T 细胞共刺激受体的差异诱导选择性地驱动两种类型的免疫,这一过程受到 TLR 刺激方式的高度影响和控制。131
在过去几十年的几项研究的支持下,过敏性哮喘与环境微生物以及微生物群的相关性现在是无可争议的。在这种情况下,细胞表面 TLR 和 MAMP 的相互作用已被广泛研究,并显示出对哮喘发展或进展具有保护或恶化作用,并在别处进行了综述。对于 TLR3、TLR7 和 TLR8,现在已经确定它们的激活优先通过诱导干扰素导致T H 1 极化。由于鼻病毒 (RV) 感染是哮喘恶化的最常见诱因,这一点变得很明显,因此 RNA 感应 TLR 成为开发新疗法的目标。
哮喘患者的原代支气管上皮细胞无法对 RV 感染产生足够的 I 型和 III 型免疫反应,与 RV 感染的健康对照相比,TLR3 表达没有改变。另外,羊,等人证实在小鼠中的卵清蛋白(OVA)诱发的哮喘症状与合成TLR3配聚另外处理的动物更深刻(I:C)。然而,在一项人体安慰剂对照研究中,使用 TLR3 抑制性抗体在改变病毒诱导对肺功能和哮喘控制的影响方面无效,当哮喘患者感染 RV 时,但减少了健康组的感冒症状。
由于最近才发现小鼠和人类 RNA 感应 TLR 的功能差异,因此长期以来,小鼠 TLR13 和人类 TLR8 的作用大多被忽视。然而,有明确的证据表明 TLR7 和 TLR8 与哮喘有关。研究由穆勒-拉森进行,等人和章,等人确定的TLR7和TLR8的与丹麦哮喘和特应性疾病和中国队列的序列中的单核苷酸多态性(SNP)的相关性。这些 SNP 可能会影响 TLR7 加工和 TLR8 剪接。此外,Shikhagaie ,等人和Rupani ,等人发现 TLR7 在支气管活检和严重哮喘患者的肺泡巨噬细胞中减少。Rupani 等人还表明,TLR7 缺乏是由于某些 microRNA 的表达增强,并且通过它们的抑制,TLR7 表达和 RV 诱导的干扰素反应得到恢复,这将这些 microRNA 确定为潜在的治疗靶点。
最近测试了不同的合成 TLR7 和 TLR8 激动剂作为治疗剂的适用性(表 2)。TLR7 配体咪喹莫特(也称为 R837)对新豚鼠气道诱导的支气管收缩表现出急性松弛作用。对于其他 TLR7/8 激动剂,如 R848、CL097 和加地喹莫特,以及 PolyU 和 PolyA,也观察到了这些短期效应。在慢性哮喘的小鼠模型中,咪喹莫特显着抑制了由 OVA 长时间激发引起的气道炎症、高反应性和重塑。迄今为止,咪喹莫特作为人类哮喘治疗剂的适用性尚未经过测试,但被用作 FDA 批准的药物,用于治疗其他非呼吸系统疾病(Aldara ®, MEDA Pharma, Solda, 瑞典)。AZD8848 (AstraZeneca, Cambridge, UK) 是一种 TLR7 激动剂,目前正在一项治疗哮喘和过敏性鼻炎的 II 期临床试验中进行测试 (NCT00999466)。第一个结果表明,AZD8848 的鼻内给药激活了 TLR7,诱导了 IFN 反应,并减少了过敏原激发后过敏性鼻炎患者的鼻部症状。另一种 TLR7 激动剂 GSK2245035 正在 II 期测试治疗过敏性哮喘(葛兰素史克公司,NCT02833974,伦敦,英国)。其安全性和有效性已经过测试,但结果尚未公布。
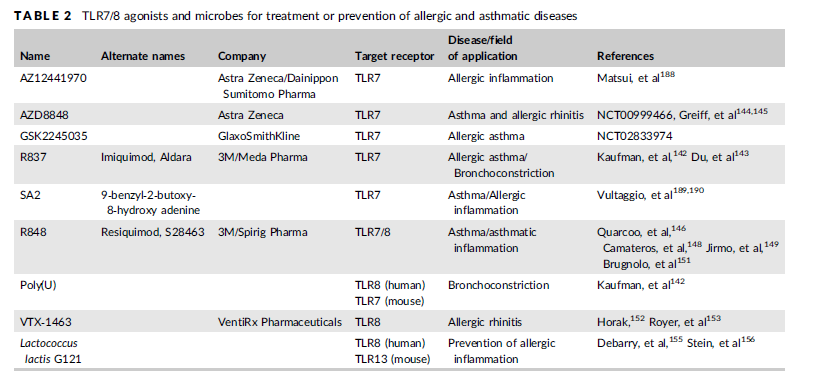
R848(也称为瑞喹莫特或 S28463)在结构上与咪喹莫特相似,但被描述为更有效。这种 TLR7 和 TLR8 激动剂目前用于开发与咪喹莫特(Spirig Pharma,Egerkingen,Switzerland)具有相似应用领域的药物。在不同的小鼠模型中,R848 被证明是实验诱导的急性哮喘炎症的有效抑制剂,甚至通过在 TLR8 中诱导 IFN-γ 和 T H 1 极化细胞因子 IL-12抑制 T H 2 反应来逆转已建立的哮喘-依赖方式。在人类 moDC 中也可以观察到 R848 对 IL-12 的诱导,并且这些细胞被准备好诱导 T H 1 极化。Brugnolo ,等人甚至表明,R848移位Ť ħ 2个效应细胞到IFN-γ产生细胞。VTX-1463 在 Horak 于 2011 年的一篇综述中被介绍为一种有前途的、选择性的、能够治疗过敏性鼻炎的 TLR8 配体。使用豚草致敏狗的体内实验表明,鼻内给药 VTX-1463 可重复减少过敏原激发后的急性过敏反应。在对草花粉过敏患者进行的人体研究中也可以观察到这种效果,尽管这些数据没有直接发表,而是在 Horak 的评论中进行了讨论。
自从 Strachan 提出卫生假说以来,有越来越多的证据表明微生物环境对哮喘和过敏的进展有巨大影响。某些细菌种类已被证明可以预防急性过敏性炎症小鼠模型中的过敏性疾病,例如牛棚分离株乳酸乳球菌G121。2007 年,我们的小组证明用这种细菌治疗小鼠对 OVA 诱导的急性过敏性炎症的发展具有保护作用。在进一步的实验中,我们提供了证据表明这种效应是通过乳酸乳球菌G121 RNA激活 TLR13 介导的。然而,在人类 moDC 中,细菌会激活 TLR8,从而导致大量 Tħ 1个偏振主要由细胞因子IL-12(图介导 4的B)。
了解 RNA 传感 TLR 对过敏性呼吸道疾病的影响的研究才刚刚开始,迄今为止,关于 TLR7/8 配体作为药物的适用性仍然缺乏足够数量的临床研究。然而,解决 TLR7 和 TLR8 不仅对于治疗持续性过敏性鼻炎和哮喘而且对于它们的预防都具有很高的潜力。
6、 内体 TLRS 和自身免疫对内源性 RNA 的识别
对 NA 的识别极大地扩展了分子模式的全部内容;然而,它们的检测伴随着潜在的危险,因为 PRR 区分外来和内源性 NA 的能力是有限的。因此,几种自身免疫性疾病是基于通过内源性 NA 激活免疫系统,包括 SLE、类风湿性关节炎 (RA)、婴儿期发病的 STING 相关血管病 (SAVI) 和 Aicardi-Goutières 综合征 (AGS)。然而,存在阻止通过内源性 RNA 激活 PRRs 的机制和要求。如上所述,TLR7 和 TLR8 感知 ssRNA 的降解产物。这意味着需要通过迄今为止未描述的机制对 RNA 进行内体加工。与微生物 RNA 相比,宿主衍生的 RNA 的转染不会激活 TLR7/ 8,可能是由于高等真核生物的 RNA 的高修饰率。事实上,已经描述了几种抑制 TLR7/8 激活的 RNA 修饰。抑制免疫激活的第一个也是描述最清楚的修饰之一是 2'-O-甲基化。其他抑制修饰包括掺入假尿苷 (Ψ)、N6-甲基腺苷 (m6A)、5-甲基胞苷 (m5C)、5-甲基尿苷 (m5U) 或 2-硫尿苷 (s2U)。然而,已经证明来自垂死宿主细胞的自身 RNA 仍然可以激活 TLR7/8,例如作为与抗微生物肽 LL37 165的复合物或作为 U1 小核核糖核蛋白颗粒 (snRNP) 的一部分。虽然长 dsRNA(TLR3 的配体)通常不存在于真核细胞中,但压力或受伤组织释放的 RNA 可以激活 TLR3 并引起体内炎症反应。事实上,一些研究表明自身免疫性疾病(如 SLE、RA 或干燥综合征)与 TLR3、TLR7 或 TLR8 及其各自信号通路的改变之间存在相关性。
RNA 感应 TLR 在自身免疫中的关键作用已被证明对于 SLE——一种慢性自身免疫性疾病,在北美的患病率为每 10 万人 241 人,并且对女性有很强的偏见。该疾病的特点是高度异质性,具有复杂的症状,如皮肤病变、关节炎、贫血和肾小球肾炎。SLE 患者通常会产生高水平的抗核抗体 (ANA) 和 IFN-α,这是由 pDC 和 B 细胞通过 TLR7 过度活化所驱动的。已经通过不同的 SLE 小鼠模型揭示了 TLR7 在疾病发作中的重要作用。Giltiay 等人已经证明小鼠中 TLR7 的过表达可导致 SLE 症状的表现。因此,在易患狼疮的 MLR/lpr 小鼠中删除 TLR7 会阻止自身抗体的产生并降低淋巴细胞的活化。与这一发现一致,通过删除 TREML4 或补充半乳糖凝集素 9 抑制 TLR7 信号通路都可以改善疾病症状。此外,它最近被Souyris所示,等人位于 X 染色体上的 TLR7 可以逃避 SLE 患者的 X 染色体沉默,这可能解释了这种疾病的女性偏见。由于人类和啮齿动物 TLR8 之间的差异,人类 TLR8 在 SLE 中的作用不太清楚。在小鼠中,mTLR8 阻碍 TLR7 诱导的自身免疫;然而,hTLR8 转基因小鼠会出现严重的炎症。119因此,需要付出更多努力来了解 TLR8 在人类狼疮疾病中的作用。
了解受体-配体相互作用和分子途径对于抑制或增强这些免疫反应非常重要。这些知识最近导致了新的 TLR8 拮抗剂的开发,即 CU-CPT 9 衍生物,它稳定受体的静息状态以抑制其激活。拮抗剂的 IC50 值在 nM-pM 范围内,表现出高特异性,能够区分 TLR7 和 TLR8,与之前的抑制剂相比,这种能力更胜一筹。这种新型拮抗剂有望转移到其他 TLR 上,并可能为患有 SLE 或 RA 等自身免疫性疾病的患者提供更好的治疗选择。
7、 展望
过去几年为 RNA 特异性 TLR 的结构、功能和生物学意义提供了重要的新见解。这些受体已被证明在针对各种病原体的免疫中很重要,但是,对内源性配体的反应不足仍会引发危险的自身免疫反应。另一方面,靶向 TLR7/8 是治疗和预防过敏性疾病的一种有前景的治疗选择。当然,处理研究 TLR 依赖性 RNA 识别在啮齿动物中的作用的研究很重要,因为由于鼠和人 TLR7 和 TLR8 之间的差异,它们不能简单地翻译给人类。猪或牛等其他动物可以作为更好的模型系统。 了解 TLR8 在体内的作用可以为过敏保护、自身免疫性疾病的治疗和疫苗接种的改进开辟道路。
参考资料
- https://onlinelibrary.wiley.com/doi/full/10.1111/all.13680 。RNA is taking its Toll: Impact of RNA-specific Toll-like receptors on health and disease。 First published: 26 November 2018
- https://dash.harvard.edu/handle/1/41121328
