【9.3.4】mRNA polyA
四年前,在高等生物和大肠杆菌中发现了从 ATP合成聚腺苷酸的密切相关的酶(poly(A) 聚合酶,或 PAPs)(关于聚腺苷酸化的全面回顾,包括历史方面,请参见埃德蒙兹 2002)。不久之后,PAP 介导的 3' mRNA 末端多聚腺苷酸化被认为是真核 mRNA 几乎普遍的特征。相比之下,尽管关于大肠杆菌、枯草芽孢杆菌和古细菌的开创性报道,细菌中的 mRNA 多聚腺苷酸化长期以来被认为是轶事(anecdotal )(萨卡 1997)。这是因为与真核细胞不同,在野生型大肠杆菌细胞中,在给定时间只有一小部分 mRNA 被可测量地聚腺苷酸化。我们现在知道,这种稀缺性并不意味着聚腺苷酸化是罕见的,而只是 PAP 和去除细胞中 poly(A) 尾部的外切核酸酶的相对活性使得 poly(A) 尾部长度保持最小。尽管细菌聚腺苷酸化的存在不再有争议,但与真核生物相比,poly(A) 尾巴的代谢,更重要的是,它们的生物学作用——尤其是它们对 mRNA 稳定性的影响——在真细菌中几乎完全不同。专注于大肠杆菌,在这方面的研究最多,我们讨论了与真细菌和真核生物中基因表达机制有关的这些差异(有关不同范围的相关讨论,请参见 卡普西斯等人。1999年)。 真核 mRNA 的多聚腺苷酸化最初发生在细胞核中,在那里它与初级转录物切割和转录终止紧密耦合(参见 Proudfoot 等。2002年,供审查)。通常,这个初始的聚腺苷酸化步骤是 mRNA 寿命期间唯一发生的此类事件。去腺苷酸化通常发生在细胞质中,并且是不可逆的(图 1A)。有趣的是,尽管真核细胞的细胞质中存在各种 3'→5' 核酸外切酶(参见酵母外泌体),但去腺苷酸化似乎是由专门的核酸外切酶进行的(塔克等人。2001年)。相反,由于没有核膜,poly(A) 的合成和降解发生在大肠杆菌的同一隔室中。此外,多聚腺苷酸化不仅可以发生在成熟的 mRNA 上,还可以发生在由内切或外切降解产生的片段上,甚至发生在稳定的 RNA 或其前体上。事实上,任何可接近的 3' 末端似乎都是大肠杆菌中多聚腺苷酸化的潜在目标(图 1B;Haugel-Nielsen 等人。1996年)。这种差异可以归因于这样一个事实,与在转录终止复合物内起作用的真核 PAP(图 1A)相反,细菌 PAP 独立运行或在参与 mRNA 衰变的复合物中起作用(见下文)。最后,在大肠杆菌中没有已知的严格的聚 (A) 特异性外切核酸酶。相反,参与 mRNA 体降解的 3'→5' 外切核糖核酸酶、RNase II 和多核苷酸磷酸化酶 (PNPase) 似乎也能够去除聚 (A) 尾。、
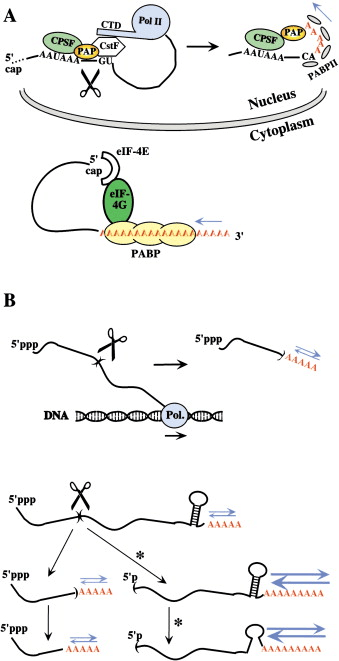
然而,仔细观察可用数据会在某种程度上减弱这种对比鲜明的画面。在许多后生动物胚胎的早期发育过程中,母体来源的休眠 mRNA 在细胞质中被聚腺苷酸化,最近在酵母中也记录了一个特定的细胞质聚腺苷酸化病例(见斋藤等人。2002年,以及其中的参考资料)。因此,真核 mRNA 最终在同一细胞区室中被去腺苷酸化和再去腺苷酸化,就像细菌 mRNA 一样。其次,即使是核聚腺苷酸化也可以独立于切割发生,这也类似于原核生物中的情况。例如,终止子读取产生的延伸 mRNA 可以被外泌体修剪掉,然后在酵母中从头多聚腺苷酸化。火炬等人。2002年)。第三,大肠杆菌酶 RNase II 和 PNPase 在降解 poly(A) 尾部或 mRNA 体方面可能并不真正等效。虽然 RNase II 活性在细胞内超过了 PNPase 活性,但它对 RNA 结构更敏感。因此,无结构的 poly(A) 尾部更有可能被 RNase II 去除,而 mRNA 的结构性更强的内部区域主要被 PNPase 降解。在这方面,RNase II 和 PNPase 分别相当于真核聚 (A) 特异性外切核酸酶和外泌体。有趣的是,PNPase 被认为在结构上等同于外泌体核心(西蒙斯等人。2002年)。真核生物和真细菌中 poly(A) 代谢之间的这些形式相似性在多大程度上扩展到 poly(A) 功能,尤其是在 mRNA 衰变方面?
mRNA 衰变的途径在真核生物和大肠杆菌中截然不同。 在酵母和高等生物中,细胞质 mRNA 的降解通常由 poly(A) 缩短引发(有关真核 mRNA 衰变的综述,请参见威卢兹等人。2001年)。这个初始步骤通常也是限速的,即大多数 mRNA 的寿命取决于将它们去腺苷酸化所需的时间(参见塔克等人。2001年,用于支持论点)。 因此,poly(A) 尾部充当稳定元素。去除后,去腺苷酸化的 mRNA 会迅速脱帽,然后被 5'-3' 核酸外切酶 Xrn1p(在酵母中)降解;或者(不太频繁),它可以进入由细胞质外泌体介导的 3'→5' 降解途径。相比之下,大肠杆菌中不存在 5'→3' 核酸外切酶,参与 mRNA 衰变的 3'→5' 核酸外切酶(大概主要是 PNPase)的作用通常仅限于片段的清除。事实上,对大多数完整 mRNA 的初始攻击是由核酸内切酶介导的,通常是 RNase E(有关细菌 mRNA 衰变的评论,请参见科本和麦基 1999, Grunberg-Manago 1999)。至于 poly(A) 尾巴,有充分的证据表明,与真核情况形成鲜明对比的是,它们破坏了稳定RNA 通过促进核酸外切攻击。体外和体内数据表明,与 RNA 体的核酸外切降解相比,去腺苷酸化是快速的(特别是如果这种 RNA 是结构化的),并且去腺苷酸化最终是可逆的:poly(A) 尾部可以被 RNase II 重复降解和重新合成/分别为 PNPase 和 PAP。因此,poly(A) 尾巴将提供一个“立足点”,PNPase 可以从中反复攻击 RNA 的主体,直到结构最终呼吸并可以被入侵。该模型与真核生物中 poly(A) 去除缓慢且不可逆的情况形成对比,很好地解释了为什么 RNase II 被发现具有 mRNA 稳定因子的作用;事实上,它会去除 poly(A) 尾部,而不能有效地降解其余的 RNA。大肠杆菌,而在真核生物中则相反。一个合理的猜测是无结构的 poly(A) 尾巴本质上对核酸外切酶非常敏感,但在体内它们受到蛋白质的保护。事实上,Poly(A) 结合蛋白(PABP;图 1A)在哺乳动物无细胞试验中抑制去腺苷酸化。尽管聚 (A) 结合蛋白也存在于大肠杆菌中,并且虽然它们可以在体外保护聚 (A) 尾巴免受 PNPase 的影响。冯等人。2001年),它们可能无法在体内发挥显着的保护作用,因为 poly(A) 尾巴的长度永远不会长到足以使它们结合。 铁汉 09:10:08 因此,与真核生物相比,聚腺苷酸化对细菌 mRNA 稳定性的对比影响可能反映了聚 (A) 尾上不存在 PABP,加上去腺苷酸化很容易可逆的事实。如上所述,细菌的另一个显着特征是聚腺苷酸化通常会影响片段的降解只是,因为对大多数完整 mRNA 的初始攻击是核酸内切。对模型分子 RNA I 的研究表明,这种时间层次反映了先前的核酸内切酶裂解对核酸外切酶降解的激活。这种 108 nt 调控 RNA 的衰变类似于典型 mRNA 的衰变;特别是,它是由 RNase E 从 5' 末端切割 5 nt 开始的。虽然这种适度的截断不太可能影响 RNA 结构(它不会取消生物活性),但它足以通过 PAP-PNPase 途径激活非常快速的衰变。徐和科恩 1995)。存在有序的内切和外切核酸攻击的其他显着例子(有关审查,请参见Régnier 和 Marujo 2002)。这种有序作用的分子基础可能在于 RNase E 本身的不寻常特性。首先,该酶在“降解体”中与 PNPase 结合,该“降解体”还特别包含 RNA 解旋酶 RhlB。至于PAP,即使不与降解体共纯化,在体外也能与RNase E和RhlB相互作用。雷纳尔和卡普西斯 1999)。其次,尽管它是一种核酸内切酶,但 RNase E 优先切割带有可接近的 5' 单磷酸 (5’p) 末端的底物,表明它与此类 5' 末端特异性结合。科本和麦基 1999)。可以想象,通过将降解体连接到新形成的 5’p 末端,初始 RNase E 切割会将 PNPase 和/或 PAP 带到同一片段的 3' 末端附近,有利于多聚腺苷酸化降解循环(放大的蓝色箭头)在图 1B 中,路径用星号标记)。通过这种方式,核酸外切途径将被先前的核酸内切酶切割激活。或者,这种激活可能不涉及降解体。有体外证据表明纯化的 PAP 和 PNPase,如 RNase E,在带有 5’p 而不是 5’ppp 末端的底物上更具活性。冯和科恩 2000, 徐和科恩 1995)。尽管这种偏好的原因尚不清楚,但它可能有助于在 RNase E 裂解后激活 PAP-PNPase 途径。
尽管核酸内切酶和核酸外切酶的有序作用可能是大肠杆菌中的规则,但它可能不是绝对的。事实上,PAP 似乎也在一些完整 mRNA 的降解中发挥作用(见莫汉蒂和库什纳 1999,以及其中的参考资料)。此外,错误折叠的“稳定”RNA 的前体也可能成为 PAP/PNPase 介导的衰变降解的目标。因此,该通路参与 RNA 质量控制(李等人。2002年)。有趣的是,最近在真核生物中发现的另一种 RNA 质量控制机制与 PAP/PNPase 介导的衰变有一些相似之处。缺乏终止密码子的多腺苷酸化 mRNA(“不间断”mRNA)会被酵母细胞质中的外泌体迅速降解。范霍夫等。2002年)。这种情况类似于 PNPase/PAP 介导的衰变,因为 poly(A) 尾巴不能保护不间断的 mRNA,并且它可能被与 mRNA 主体相同的机制(即外泌体)降解。然而,这个类比有其局限性。在这种情况下,不知道去腺苷酸化是否比 mRNA 体的降解发生得更快,也不知道它是否可以帮助这种降解。此外,poly(A) 尾巴本身似乎并不作为外泌体的立足点。相反,正是在 poly(A) 3' 末端停滞的核糖体的存在被认为介导了外泌体募集,这是该机制的一个独特特征。
未来的工作将显示当前的想法是否反映了更普遍的情况。众所周知,在酵母中,有效的 mRNA 降解不仅发生在细胞质中,而且发生在细胞核中。然而,poly(A) 尾部对核降解的影响仍不清楚。我们对除大肠杆菌以外的细菌中 poly(A) 功能的了解也很有限。然而,有趣的是,有证据表明,在叶绿体和线粒体中,poly(A) 尾巴会破坏它们所附加的 mRNA 的稳定性,就像在大肠杆菌中一样。
mRNA 3’末端的多聚腺苷酸化构成了一个古老的特征,它在整个生命世界中的发生以及PAP序列的保守性证明了这一点。卡普西斯等人。1999年)。除了在 mRNA 转换中的作用外,聚腺苷酸化在真核基因表达中还发挥着其他重要作用,这些作用在细菌中是不存在的,例如,将 mRNA 从细胞核转运到细胞质或翻译。聚腺苷酸化对真核生物和细菌中 mRNA 衰变的对比影响只是对这种看似简单、通用的 RNA 修饰的显着功能多功能性的又一例证。
参考资料
- https://www.cell.com/fulltext/S0092-8674(02)01137-6 。 VOLUME 111, ISSUE 5, P611-613, NOVEMBER 27, 2002
