【6.7.1】最新开发的策略可最大程度地减少CRISPR-Cas介导的基因组编辑中的脱靶效应
最新开发的策略可最大程度地减少CRISPR-Cas介导的基因组编辑中的脱靶效应
通过删除或添加而在基因组中对目标基因进行修饰的基因编辑,彻底改变了生物医学的时代。与常规基因编辑工具(包括锌指核酸酶(ZFN)和转录激活因子样效应子核酸酶)相比,常规使用的簇簇定期回文的短回文重复序列(CRISPR,Clustered regularly interspaced short palindromic repeats )/ Cas9由于其使用简单,成本低且效率高而成为一种重要的工具( TALENs )。然而,潜在的脱靶活性是CRISPR系统中的关键缺陷。已经开发出许多类型的方法来减少脱靶效应。在这里,我们回顾了几种减少脱靶效应的最新方法,包括偏靶或无偏靶检测,胞嘧啶或腺嘌呤碱基编辑器,主要编辑,dCas9,Cas9配对切口酶,核糖核蛋白(RNP)递送和截短的gRNA。这篇评论文章提供了广泛的信息,以谨慎地解释脱靶效应,以辅助生物医学的基础和临床应用。
一、前言
基因组编辑是一种强大的工具集,涉及到DNA序列的有意改变,正引领着针对癌症,遗传疾病等的分子医学新时代[1]。当前可用的编辑方法包括锌指核酸酶(ZFN),转录激活子样效应子核酸酶(TALEN)和成簇的规则间隔的短回文重复序列(CRISPR)。 CRISPR被认为是古细菌和细菌的抗病毒免疫系统,后来被用作基因编辑的有效工具[2]。 CRISPR / Cas9比ZFN和TALEN广泛用于基因编辑,因为它具有成本效益,高效,易用和高效的特点[3]。 CRISPR / Cas9的成分是指导RNA(gRNA)和Cas9核酸酶。 gRNA是一种定制设计的短核苷酸碱基RNA,可募集Cas9来切割和编辑基因组中的特定基因座。 CRISPR / Cas9在双链DNA内诱导特定的双链断裂(DSB),从而触发DNA修复途径,例如非同源末端连接(NHEJ)为基因敲除(KO)或同源直接修复途径引入移码突变(HDR)通过提供的模板DNA进行基因替换或基因敲入(KI)[4]。 CRISPR / Cas9基因组编辑已在细菌[5],植物[6]和哺乳动物[7,8]中得到利用。 CRISPR / Cas9在未来的临床遗传学中具有治疗潜力,这导致美国批准了减少遗传疾病的临床试验[9]。表1所示的核酸酶平台上CRISPR / Cas,ZFN和TALEN之间的临床试验数据和比较特征。

几项研究表明,Cas9结合了意想不到的基因组位点进行切割,称为脱靶效应[10]。 CRISPR / Cas9的靶效率通过与靶基因座相邻的20个gRNA和PAM位点的核苷酸序列确定。靶序列与gRNA的20个核苷酸之间的三个以上错配会导致脱靶效应[11]。已经证明,PAM远端有4个错配会引起脱靶效应[12]。研究人员提出了两种类型的脱靶作用,第一种类型的脱靶作用可能是由于靶基因座的序列同源性而发生的,而第二种类型的脱靶位点发生在基因组中而不是靶位点。脱靶效应在生物体的基因组水平上引起严重的问题,大的缺失和基因组重排,由于dsDNA断裂而很少发生[13]。脱靶效应可能导致致命的基因突变,导致基因功能丧失,最终导致动物的癌细胞和植物的不良表型(疾病敏感性)[14](图1)。
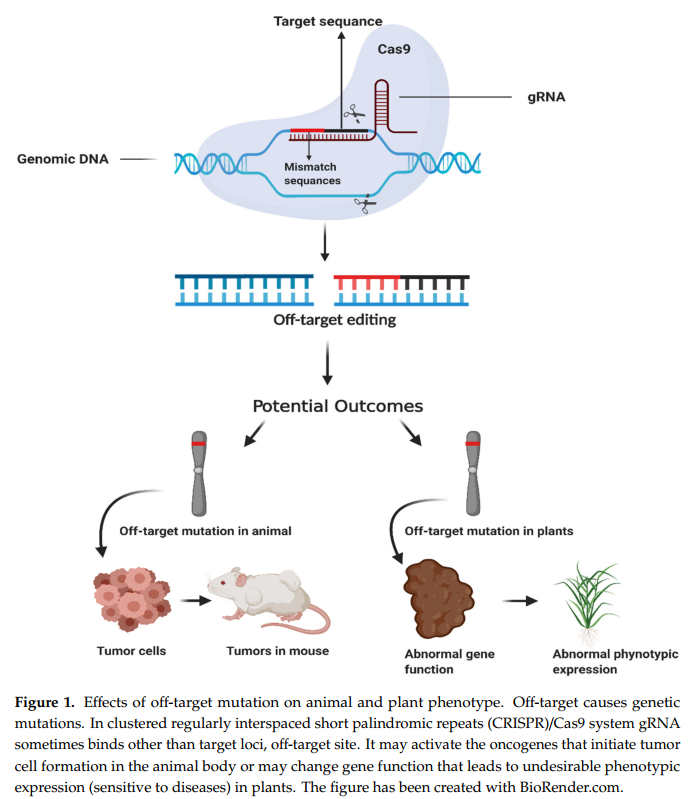
CRISPR-Cas9系统的优势在于可以以不同的形式进行转移。 质粒/病毒载体中的Cas9–gRNA核糖核蛋白(RNP)和具有独特gRNA的Cas9,mRNA。 通过病毒载体体内递送CRISPR / Cas9与临床应用面临一些挑战,包括; CRISPR-Cas9的延长表达,相对较高的生产成本,免疫原性和意想不到的诱变以及在脱靶组织中的编辑[15]。 任何基因组编辑治疗的临床前开发都需要在人类进行直接测试之前减轻和彻底研究脱靶风险。 如果所选基因座与其余基因组序列具有相对较低的同源性,则它是理想的。 本文回顾并重点介绍了与最新开发的策略相关的CRISPR / Cas9,以减少CRISPR介导的基因组编辑中的脱靶效应或限制。
二、减轻脱靶效应:有偏和无偏的脱靶检测方法(Mitigation of Off-Target Effects: Biased and Unbiased Off-Target Detection Methods)
天然CRISPR / Cas9系统是细菌中的一种适应性免疫系统,可保护细菌基因组完整性免受入侵病毒的侵害[4]。由于基因组的大小比真核基因组小,因此Cas9在细菌中的特异性很高,后者比细菌大1000倍。细菌中的Cas9进化过程中没有选择压力。因此,与细菌相比,在哺乳动物基因组中脱靶效应的可能性更高[18]。脱靶切割位点已在基因编辑技术,CRISPR / Cas9,ZFNs和TALEN中检测到[19],但在基因敲除工具如RNA干扰(RNAi)和反义[20,21]中也已检测到。基因编辑中的脱靶效应在临床治疗中造成严重风险。研究人员发现了体内/体外生化分析和基于算法的计算方法,可以检测和量化脱靶效应,从而提高基因编辑效率。脱靶检测方法分为两组:有偏检测和无偏检测。
2.1 偏向
精心设计gRNA对于精确的CRISPR / Cas9靶向至关重要。对于成功的CRISPR / Cas9研究,可以通过计算机工具预测脱靶效应[22]。作者发现,CRISPR / Cas9可以在一定条件下产生脱靶位点。此外,许多科学家开始通过使用具有不同策略的不同CRISPR系统在目标外的站点上产生大量数据[23,24,25]。生成的数据用于开发基于算法的计算机模拟预测模型,以检测和量化脱靶效应。计算机预测可以通过算法设计的软件将脱靶效应降至最低。基于算法的模型可分为两类:
1。 基于比对的模型;基于常规算法,其中gRNA与参考基因组比对,脱靶效应基于序列同源性返回; 2. 基于评分的模型,经过先进的算法设计,根据给定的分数和基于确定的脱靶位点的排名,为实验选择了最合适的gRNA [26,27]。偏置方法见表2。

2.1.1。基于对齐的模型 Alignment Based Models
在此,以同源性为基础将gRNA序列与参考基因组序列比对后预测的脱靶位点。它包括Bowtie,BWN,CasOT,Cas-OFFinder,FlashFry和CrisFlash。
- Bowtie和BWN是检测基于简单比对的脱靶效应的理想工具,它可以检测出多达一个失配的脱靶[28,29]。 CRISPR / Cas9目标在线预测因子(CCTop,http://crispr.cos.uni-heidelberg.de )利用Bowtie来检测脱靶活动,该活动可识别与原始间隔子序列匹配和不匹配的PAM位点,然后按不同的方式进行搜索参数。
- 在CCToP中,最多允许五个不匹配项,其中五个不匹配项阻止或抑制了DSB的创建[30]。设计gRNA工具的CRISPOR使用BWA而不是Bowtie来确定脱靶活动。
- CRSIPOR可以预测所有脱靶效应[31]。 Cas-OFFinder是检测目标外站点的通用工具。
- Cas-OFFinder的优点是无限数量的PAM品种,错配和gRNA长度。使用Cas-OFFinder仅需删除/插入一对碱基对就可以确定脱靶位点[32]。
- CasOT是一种算法计算工具,用于从输入数据序列中检测目标上的位点,可以发现种子中所有潜在的目标外位点〜6个不匹配(12-nt相邻的PAM)。该工具对于检测脱靶是在外显子还是内含子中很有用[33]。
- 最近,开发了模型,即FlashFry和Crisflash。 FlashFry可以迅速找到潜在的脱靶位点,并提供有关GC含量的有价值信息,目标基因座的开/关靶得分[34]。 Crisflash利用基于树的算法设计gRNA,并结合了用户提供的变异数据以提高其准确性[35]。
在基于比对的方法中,Cas-OFFinder是查找潜在脱靶位点的更好模型,而FlashFry的总体结果高效且速度高[27]。
2.1.2 基于评分的模型 Scoring-Based Models
它包括MIT,CFD,CRISTA,Elevation和DeepCRISPR。
-
MIT(Hsu-Zhang)得分用于在基因编辑的早期阶段发现潜在的脱靶位点。作者评估了> 700个gRNA变体。根据靶标20 bp中的错配位置,计算权重矩阵以确定每个gRNA的脱靶效应。 MIT分数纳入了CHOPCHOP和CRISPOR sgRNA设计工具中[31,41]。
-
切削频率确定(CFD)被认为是脱靶评估的普遍得分。 Guide-seq用于CFD评分验证,其表现优于MIT评分[36]。 CFD分数与gRNA设计工具(即GuideScan和CRISPOR)集成[42,43]。
-
CRISPR目标评估(CRISTA)是一种脱靶搜索工具,具有众多功能,包括GC含量,RNA二级结构,DNA甲基化或表观遗传因素,可预测切割效率。 CRISTA的表现优于CDF,CCTop和MIT [38]。
-
不同的研究报道了DNA的可及性(DNA甲基化和染色质结构)可以影响CRISPR在细胞中的切割。为了克服这个问题,Doenche实验室开发了两层回归模型,即 Elevation,该模型同时获取序列和DNA可及性/表观遗传数据,以找出潜在的脱靶效应。Elevation可以预测gRNA的单个脱靶得分以及gRNA的总得分。标高比MIT,CDF和CCTop更好。但是,唯一的限制是它仅计算人类外显子组(GRCh38)的脱靶位点,不适用于其他生物[39]。
-
另一个最新开发的工具DeepCRISPR用于计算生物学,可同时预测目标上和目标外的切割位点。它还包括影响KO / KI sgRNA效率的表观遗传学特征[40]
在基于评分的方法中,Elevation 方法被证明是发现所有潜在的脱靶切割位点的最新有效且有效的工具[36,44]。
2.2 无偏见 Unbiased
无偏方法可以在整个基因组水平上检测活细胞中意外的切割位点。 这些方法分为体外检测或体外全基因组测定以及体内检测或基于细胞的全基因组测定。 表3中说明了无偏工具。
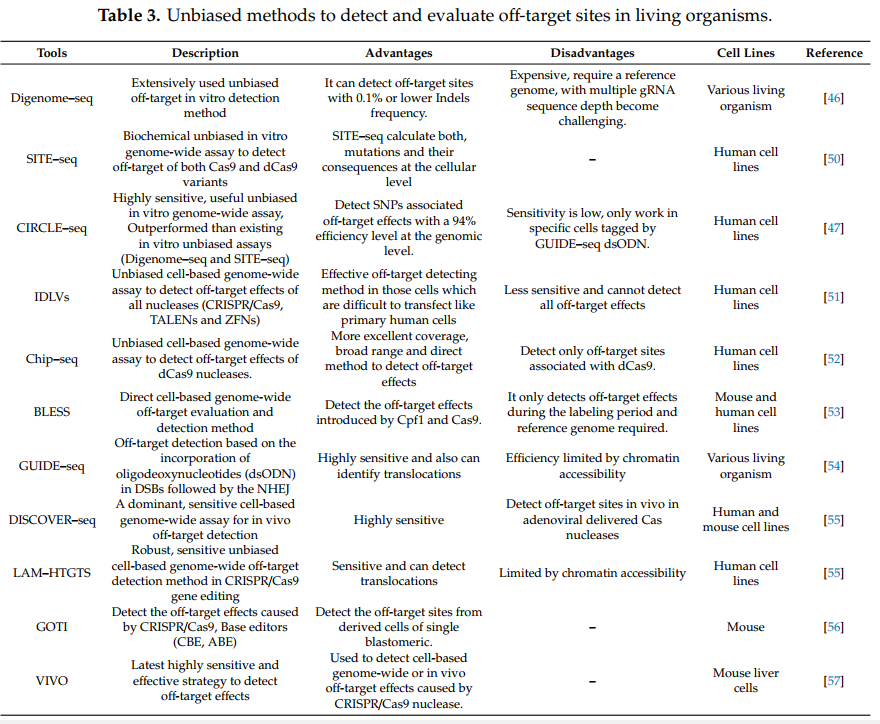
2.2.1 体外检测 In Vitro Detection
用于检测和定量脱靶效应的体外全基因组检测主要包括Digenome-seq,SITE-seq和CIRCLE-seq。
-
Digested 基因组测序(Digenome-seq)是一种检测Cas9和其他核酸酶的全基因组脱靶效应的可靠,灵敏且广泛使用的方法。 Digenome–seq的灵敏度为0.1%或更低。 Digenome-seq需要较高的读取深度,这使其灵敏度较低,不适合筛选大量gRNA [45,46]。
-
通过测序(SITE-Seq)选择性富集和鉴定标记的基因组DNA末端,并通过测序(CIRCLE-seq)进行环化以体外报道裂解效应[2],这是克服Digenome–seq问题的最流行技术。基因组内的所有Cas9切割位点都可以通过SITE-Seq方法进行定位。其中执行的sgRNA和Cas9 RNP用于在无细胞系统中切割纯化的基因组DNA。接下来,对目标上和目标外的切割片段都进行标记,然后进行下一代测序(NGS),以检测目标外的位点。核酸酶浓度很大程度上取决于脱靶位点的总量。 RNP(低至高)用作可变浓度,以恢复低和高切割敏感性脱靶位点。当在细胞中进行鉴定时,低浓度的RNP具有较高的脱靶突变倾向。此外,与Digenome-seq [47,48]相比,SITE-Seq需要的NGS读取深度最小。
-
CIRCLE-Seq具有类似的概念,但在程序上有所不同。在CIRCLE-Seq中,最初修剪,环化的DNA最终被降解。在用(Cas9–sgRNA)RNPs处理之前,降解步骤实际上消除了高背景DNA,从而增加了灵敏度,从而浓缩了NGS读取空间,浪费了随机读取的时间[49]。接着,通过用Cas9切割使DNA线性化,并进一步进行NGS以进行脱靶检测。就像在SITE-Seq中一样,CIRCLE-Seq不需要参考基因组,此外,它还可以检测由于细胞类型特定的单核苷酸多态性(SNP)而减少或增强的脱靶位点。但是,环化步骤需要大量的基因组DNA,这可能是该方法的限制因素[47]。
在基于细胞的全基因组检测中,SITE-Seq和CIRCLE-Seq所发现的切割位点的数量高于活细胞中检测到的位点,这是因为除了高级染色质结构或表观遗传变化外,还缺少相关蛋白[ 47]。与Digenome-seq和SITE-seq相比,CIRCLE-seq作为一种可以检测94%脱靶位点的体外全基因组检测更好。但是,CRISLE-seq可以在用GUIDE-seq(基于细胞的体内脱靶检测法)标签标记的特定细胞中工作[47]。
2.2.2。体内检测 In Vivo Detection
体外和基于细胞的裂解,条件差异显着,体外确定的许多脱靶分子在体内未裂解(修复);因此,需要开发体内或基于细胞的全基因组检测方法来检测真正的脱靶作用。广泛使用的基于细胞的全基因组检测可检测脱靶位点,包括整合缺陷型慢病毒载体(IDLV),染色质免疫沉淀和高通量测序(Chip-seq),破坏标记,链霉亲和素富集和下一代测序( BLESS),通过测序实现全基因组,DSB的无偏鉴定(GUIDE–seq),发现原位Cas脱靶并通过测序进行验证(DISCOVER–seq),通过两次细胞胚胎注射实现全基因组脱靶分析(GOTI)和体内脱靶验证(VIVO)。
-
IDLV是识别ZFN的全基因组脱靶位点的最早工具。 IDLV与与DSB集成的基因编辑系统同时转移。提取并剪切成合适大小和片段的DNA通过接头连接。最终进行PCR检查IDLV的分布以发现脱靶效应[58]。 IDVL在那些难以像原代人类细胞一样转染的细胞中是一种有效的脱靶检测方法。 IDLV的缺点包括,它无法分析多个脱靶位点,并且脱靶检测效率为1%[51]。
-
Chip-seq是基于蛋白质DNA结合的间接体内脱靶检测方法[59]。在此工具中,Cas9替换为dCas9。它可以与不带DSB的DNA结合,从而形成脱靶检测位点[60]。然而,Chip-seq中的dCas9-gRNA复合物可以改变脱靶检测的特异性[60,61]。
-
BLESS是Cpf1,Cas9和核酸酶引入的DSB全基因组定位的最新方法。与其他DSB映射方法相比,该技术具有更通用,更灵敏和更定量的优势。此外,研究人员证明,该技术还适用于低输入细胞和组织样品中的外源和内源DSB检测[53]。它适用于小鼠和人类细胞系。但是,BLESS的局限性在于,它仅能检测标记期间的脱靶效应,并且需要参考基因组。
-
GUIDE-seq基于在DSB中掺入寡脱氧核苷酸(dsODN)和NHEJ DNA修复途径,随后整合的dsODN被扩增以检测和量化脱靶效应[54]。它具有诸如高级测序读取深度的要求之类的限制,以消除高背景问题。然而,据报道,GUIDE-Seq能够检测ChIP-seq不能识别的脱靶位点[62]。此外,它可以检测基因组中不依赖RNA的核酸酶DSB热点[26,63],GUIDE-seq的效率受到染色质可及性或表观遗传因素的限制[54]。
-
LAM–HTGTS是一种健壮,灵敏且无偏见的体内脱靶检测方法[64],由于核酸内切酶诱导的DSB末端连接,可以检测培养的哺乳动物细胞中的染色体易位。此方法取决于“诱饵” DSB和“猎物” DSB的结合,因此可能发生易位。提取,剪切基因组DNA,并通过LAM-PCR扩增诱饵-猎物连接,并准备用于NGS分析。 LAM–HTGTS的优势包括该方法能够识别由工程核酸酶的开/关靶活性诱导的所有已知类别的全基因组复发性DSB的能力。 LAM–HTGTS仅识别特定易位的DSB,在该方法中被视为漏洞,因为与那些被视为局部缺失和插入的重新结合事件相比,DSB很少导致DSB易位[26,64]。 LAM–HTGTS适用于人类基因组,其效率受到染色质可及性或表观遗传因素的限制[65]。
-
DISCOVER-Seq是一种占主导地位的基于敏感细胞的全基因组检测,用于体内脱靶检测[55]。 MRE11,ChIP-Seq和自定义Web工具BLENDER(blunt end finder, https://github.com/staciawyman/blender )是DISCOVER-Seq的主要属性。 DNA修复因子MRE11通过内源性DNA修复机制募集至DSB。然后将ChIP-Seq用于基因组上MRE11位点的精确分析,以进行脱靶位点鉴定。 DISCOVER-Seq优于GUIDE-Seq的一个优势是,前一种技术可以防止由于外源标签dsODNs在GUIDE-Seq技术中的转移而引起的细胞毒性作用。它适用于人类和小鼠细胞系。这使得能够在人诱导的多能干细胞(hiPSC)中进行脱靶位点检测[26,55]。
-
用于检测无偏向体内脱靶效应的最新开发工具是GOTI和VIVO。 GOTI最新开发的评估脱靶效应的方法是通过Cas9,胞嘧啶碱基编辑器3(CBE3)和腺嘌呤碱基编辑器-7.10(ABE 7.10)进行的[56,66]。 GOTI可以检测到由单个基因编辑的卵裂球导致的细胞外靶位。它可以在早期检测出小鼠胚胎中的脱靶位点。
-
VIVO是检测由CRISPR / Cas9引起的脱靶的最新工具。 VIVO证明,正确设计的gRNA可以有效地编辑小鼠基因组,且靶点最少。
与所有基于细胞的测定法相比,GUIDE-seq是首选,因为它成本更低,组分数量少,假阳性率低,适用于多种细胞系,并且可以检测出靶标部位的低丰度[67]。
三、缓解脱靶效应:指导RNA(gRNA)修饰和工程
CRISPR / Cas9进行的基因编辑主要取决于gRNA的特异性(与目标位点结合的gRNA数量)和效率(在目标位点产生多少gRNA的DSB),这可通过指导Cas9来切割基因组。然而,设计具有低脱靶效应的有效gRNA是一项艰巨的任务[68]。 CRISPR / Cas9的广泛应用取决于其基于合成sgRNA序列靶向DNA的能力,即在gRNA序列的5’端占据二十(20)个核苷酸的指导序列。据报道,gRNA序列被认为是提高切割效率和靶向特异性的关键因素[36]。与传统的基因组编辑工具相反,ZFN,TALEN和CRISPR / Cas9技术具有优势,因为其多重靶向突变可通过将许多gRNA实时导入细胞中而产生[69]。此外,完美的gRNA可用于最小的脱靶突变和最大的脱靶诱变。 CRISPR / Cas9系统可广泛用于增强或减少靶基因,敲入和敲除基因的表达[70]。因此,有必要仔细设计,工程改造和修饰gRNA,以规避脱靶突变。已经开发出不同的策略,例如GC含量,gRNA长度,截短的gRNA和化学修饰以减少脱靶效应。
3.1 sgRNA的GC含量
研究人员发现,gRNA的结构序列会影响CRISPR / Cas9基因编辑的靶向活性。对gRNA进行结构分析以测试其活性[71]。 gRNA序列中GC含量在40%至60%之间会增加靶向活性[72],因为较高的GC含量会稳定DNA:RNA双链体并破坏脱靶结合。 gRNA-on-gRNA序列的位置对编辑有影响,四个核苷酸末端的嘌呤残基位置可提高编辑效率。鸟嘌呤优选在gRNA的20位置和胞嘧啶在16的位置,以增加靶标编辑[71,73]。与这些发现一致,已经研究了通过诱变在sgRNA的PAM近端GC百分比之间存在正相关[74]。该参数有助于设计更好的gRNA。
3.2 长度和不匹配
许多研究表明,不想要的突变可能受gRNA长度的影响,例如其长达17个核苷酸的长度显示出更高的基因组编辑效率。相反,其长度(18–20 bp)显示出低的基因组编辑效率[75]。此外,未观察到20 bp gRNA与任何不需要的突变相关[76]。此外,部分DNA替代策略以及嵌合引导RNA被利用来减少原代人类细胞的脱靶效应[77]。在人类细胞中报告了减少潜在脱靶作用的指南:
- 应避免靶序列在PAM的7-10 bp范围内具有三个以上的错配,
- 在PAM的12 bp以内,应避免sgRNA凸起以减少脱靶效应[78]。
3.3 截短的gRNA Truncated gRNA
通过将最初20 bp的gRNA长度缩短至17/18 bp,报道的脱靶事件减少了500倍,而不会影响靶标准确性[75,79]。相反,当使用17 bp sgRNA时,在哺乳动物细胞中观察到了意想不到的最小变化[75]。 gRNA 5’端的三个核苷酸显着降低了哺乳动物细胞系统中的不良作用。将gRNA和Cas9与成对的切口酶结合可显着降低哺乳动物的脱靶效应[79]。Dead RNA脱靶抑制(dOTS)是最新开发的策略,其中指导Cas9结合但抑制切割的截短gRNA死亡导致脱靶作用降低和靶上活性增加40倍[80]。
3.4 gRNA的化学修饰
在gRNA核糖磷酸骨架中掺入2ʹ-O-甲基-3ʹ-膦酰基乙酸酯会导致位点特异性修饰,从而使脱靶裂解减少40-120倍,同时又保持了对靶的性能[81]。通过形成动态RNA-DNA双链体,将桥连和锁定的核酸整合到指导序列中,靶外特异性提高了约25,000倍[82]。 CRISPR系统的长期表达引起许多脱靶效应[77]。通过将gRNA与限制Cass9表达的Cas9共表达来设计和交付一个自我限制的CRISPR系统,从而减少脱靶效应[83]。在gRNA上游5’处修饰发夹结构可提高Cas9和Cas12的特异性,约55倍,从而降低脱靶效应[84]。
四、减轻脱靶效应:改进的Cas变体
化脓性链球菌Cas9(SpCas9)是应用最广泛的Cas9,它会产生全基因组范围内的脱靶突变,这导致科学家开发了变异的SpCas9和其他直系同源的Cas9,可以在一定程度上解决这一问题。 在这里,我们根据其起源对Cas变体进行了分类。 表4所示为Cas核酸酶变体。
4.1 SpCas9和SaCas9变体
4.1.1。具有多个融合域的SaCas9,SpCas9-Nickase,dCas9和dCas9–FokI
腺伴随病毒(AAV)由于其低免疫应答和感染broad 细胞的能力,因此是用于离体或体内基因治疗的合适载体。由于大尺寸> 1 kb,SpCas9在AAV中的包装受到限制。为了克服这个问题,可以很容易地通过AAV载体将SaCas9(一种小于1 kb的金黄色葡萄球菌衍生的Cas9变体)进行转移。 SaCas9还识别比SpCas9识别的短得多的5′-NGG-3′序列更长的PAM序列(5′-NNGRRT-3′)。从理论上讲,这意味着SaCas9期望每32 bps随机DNA识别一次其PAM序列(SpCas9会每8 bps识别一次其PAM)。这表明用SaCas9进行基因组编辑可能减少了脱靶突变的机会[98]。据报道,在人类细胞系中以RNP形式的SaCas9成功进行了基因组编辑,包括纠正X连锁青少年视网膜裂变的致病性RS1突变。靶向深度测序未发现任何脱靶效应[99]。成对的Cas9切口酶是通过HNH或RuvC结构域突变产生的SpCas9突变形式。 Cas9切口酶在一条链上产生一个切口,因此需要一对gRNA来进行有效的双链断裂。反过来,这将增加动作的特异性[65]。 Dead Cas9(dCas9)也是SpCas9的另一种变异体。 HNH和RuvC结构域均发生突变。 dCas9 + gRNA仅用于特定的DNA靶向,与转录激活,抑制和碱基编辑域融合以在基因组中产生表观遗传(基因激活或抑制)和碱基变化,而不是形成DSB(图2)。
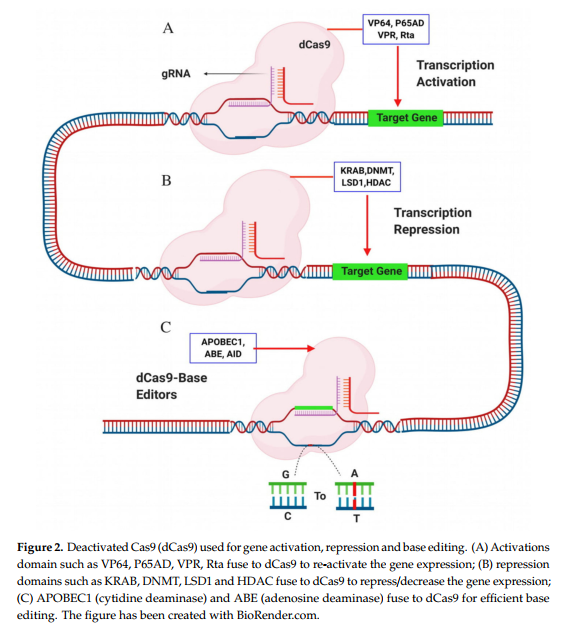
转录激活子结构域(例如VP64,P65AD,VPR,Rta和TETI)与dCas9融合以增加基因表达[100,101]。为了进一步提高基因表达,不同的小组开发了三种类型的系统:VPR(VP65-p65-Rta的三联体组合)[102],协同激活介体(SAM,与gRNA 2.0融合的dCas9-V64和转录辅助剂MS2-p65- HSF1)[102]和Sun标签激活系统(与CGN抗体结合的V64)[103]。 SAM激活系统比VPR具有更强的重新激活基因表达的能力[104]。一组人在小胶质细胞中以较少的脱靶效应重新激活了潜在的HIV基因[104]。一组人利用太阳标签激活系统有效激活了K562细胞系中的CXCR4基因表达[103]。 RNA引导的FokI核酸酶(RFN)或dCas9–FokI是由死的Cas9(dCas9)和FokI核酸酶结构域融合形成的Cas9变体。对于转录抑制,将多个域(例如KRAB [103],DNMT和LSD1)与dCs9融合以降低基因表达[105]。与其他阻遏域相比,KRAB在基因沉默或抑制中最有效[106]。与抑制域(KRAB,DNMT,LSD1,HDAC)融合的dCas9可以比早期的RNA干扰(RNAi)技术有效地将基因表达降低多达99%[107]。在人类原代细胞中,dCas9–FokI的特异性是野生型SpCas9的140倍[108]。最近,一个小组开发了工程化的嵌合RFNs / dCas9–FokI变体(GGGGS,GGGGS5,EAAAK5,XP3)。 dCas9–FokI变体,GGGGS5在HEK293 T细胞中表现出色,没有可检测到的脱靶作用[109]。碱基编辑器是编辑DNA基础的一种不可逆的新方法,包括具有胞嘧啶脱氨酶的胞嘧啶碱基编辑器(CBE)转换C–T和具有腺苷脱氨酶的腺嘌呤碱基编辑器(ABE)带有转换A–G的腺苷。 dCas9与胞苷脱氨酶,APOBEC1(dCas9-胞苷脱氨酶)或腺苷脱氨酶(dCas-腺苷脱氨酶)的融合是另一种可选择的方法,可以提高具有低脱靶效应的碱基编辑者的效率[110,111]。使用Cas9切口酶和dCas9可以实现特定基因座的版本,遗传病和作物性状增强的潜在治疗方法[85,112]。
4.1.2 xCas9,Cas9-NG,evoCas9
spCas9,xCas9和Cas9-NG的工程变体可将脱靶效应降至最低,并提高特异性。 xCas9 xCas9-3.7的变体有效地针对约16种NGN PAM,这些组合包括GAA,NG,NGG和GAT。在这方面,GAT,GAA和NG是xCas9识别的广泛PAM的一些示例。与SpCas9相比,xCas9在人类细胞中具有更高的特异性和较低的意外遗传修饰[113]。 Cas9-NG被认为是用于植物基因编辑的轻松PAM。它在植物中具有更高的特异性,但在动物中会引入带有NG PAM位点的indel [114]。 SpCas9的直接进化和其REC3域中的随机突变导致evoCas9突变体的发现。 GUIDE-seq用于评估八个不同基因座处evoCas9突变体的效率。 evoCas9中的靶向活性明显高于野生型SpCas9 [89]。
4.1.3 SpCas9–HFI,eSpCas9,Hypa-Cas9
经过工程改造的高保真SpCas9变体,SpCas9-HF1具有极高的准确性,在人细胞中确认的˃85%的sgRNA表现出微不足道的脱靶效应。由于其出色的性能,它与WT SpCas9相似,并且可能在治疗应用中使用[115]。对于人类细胞基因组编辑,增强的特异性SpCas9(eSpCas9)被认为是有用的工具。合理生成的eSpCas9(K848A,K1003A,R1060A)可以减少非目标链的结合,从而增强基因编辑的特异性[116]。但是,SpCas9–HFI和eSpCas9在基因组水平的某些目标基因座上的活性均较差[117,118]。为了克服SpCas9–HFI和eSpCas9在许多位点的低活性状态,通过SpCas9的REC3域中的点突变设计了超精确的Cas9。超精确的Cas9变体(Hypa-Cas9)在人细胞中显示出较高的靶上活性,而没有脱靶效应[86]。
4.1.4 Hypa-Cas9,Sniper–Cas9,HiFi Cas9,SpG和无PAM SpRY
Cas9的另一个变体Sniper–Cas9是通过在大肠杆菌中直接进化而开发的。 通过截短的gRNA和RNP传递,在人类细胞系中Sniper–Cas9的特异性显着高于SpCas9–HFI,eSpCas9和evoCas9突变体[87]。 最近,开发了用途广泛的Cas9变体HiFi Cas9,用于原代人细胞中的靶标活性。 与所有其他Cas9变体相比,Hifi Cas9的靶向活性略低,但用途广泛且在许多基因座上更具活性[119]。 SpG和SpRY是最新开发的Cas9变体,SpG可以靶向NGN PAM的扩展集,而SpRY是最新开发的核酸酶变体,用于有效靶向人细胞中的所有PAM位点[120]。 SpRY设计的工程师为开发具有PAM灵活性的新基因靶向技术铺平了道路。
4.2 改进的Cas9直系同源基因,具有更广泛的PAM功能和特异性
Cpf1,CRISPR-Cpf1-RNP 最初在Prevotella和Francisella 1中鉴定的另一种RNA指导的核酸内切酶是Cpf1(或Cas12a)。 CRISPR / Cas9和CRISPR / Cpf1系统之间存在一些差异。 Cpf1识别5'-TTTV-3’PAM,并且仅需要功能的crRNA(无tracrRNA)即可[121]。根据这项研究,当在玉米中进行基因组编辑时,CRISPR / Cpf1在产生目标突变时效率不如CRISPR / Cas9(90%–100%突变T0植物)(0%–60%突变的T0植物)。此外,他们的研究结果还表明,Cas9具有相对特异性,因为测序未在组成性表达Cas9和gRNA的T1植物中检测到脱靶位点的任何突变[114]。重组CRISPR-Cpf1核糖核酸蛋白(CRISPR-Cpf1-RNP)降低了小鼠细胞的脱靶活性[122]。
4.3 St1Cas9,NmCas9,FnCas9,CjCas9
Cas9来自嗜热链球菌的直系同源St1Cas9,St3Cas9,分别识别PAM序列5'-NNAGAAW-3',5'-NGGNG-3'。 St1Cas9显示出比WT SpCas9高的靶向活性[94,123]。来源于脑膜炎双球菌的NmCas9识别5-NNNNGHTT-3’PAM位点,与SpCas9相比,显示出高特异性,但脱靶位点低[124]。衍生自新孢子虫的FnCas9,其识别5'-NGG-3’PAM位点。 FnCas9可以靶向DNA和RNA。靶上活性低于SpCas9 [125]。最近,发现了一种新的最小的Cas9直系同源CjCas9,它比SpCas9具有更高的靶向活性。 CjCas9的大小比saCas9小。它可以通过AAV递送方法轻松转移到靶细胞。由于其体积小,CjCas9在治疗性基因编辑方面有前途[97]。
五、缓解脱靶效应:CRISPR递送方法
引入sgRNA / Cas9编辑机制所用的传递方法对系统的最终准确性至关重要。
5.1 改进的病毒CRISPR递送方法
腺相关病毒(AAV),作为病毒载体递送系统的一个例子,已被广泛用于在基因治疗中递送基因编辑成分。该病毒的优势是可以忽略不计的免疫反应(先天或适应性),并且与人类疾病无关或引起人类疾病[126]。然而,当用于递送CRISPR / Cas9基因编辑系统时,它具有缺点。基于病毒的递送方法通常意味着将Cas9和gRNA包装到质粒DNA中,所述质粒DNA通过病毒载体递送至靶细胞。如前所述,这允许CRISPR / Cas9组分编码基因在靶细胞类型中持久存在,这导致Cas9水平升高和脱靶活性的机会增加[127]。腺病毒(AdV)自然显示出微弱的潜力,可以整合到靶细胞基因组中,这一特性有利于限制脱靶效应。然而,AdVs引发免疫反应,目前,不可能完全排除其整合入宿主基因组的可能性[128]。
5.2 改进的非病毒CRISPR递送方法
当在Cas9和sgRNA的基于质粒的共表达到靶细胞的过程中观察到时,当编辑机制在细胞核中持续存在很长时间时,编辑成分的过度表达可能会增加脱靶突变[127]。但是,如果将Cas9蛋白和gRNA作为RNP复合物递送,则可以缩短编辑时间窗口,从而减少脱靶效应。由于核酸酶的RNP形式不含外源DNA,因此在细胞中迅速降解或在有丝分裂细胞分裂中被稀释[63]。通常,递送方法可以分为病毒的或非病毒的。电穿孔是一种使用脉冲高压电流的物理转染方法,其结果是在细胞膜上瞬时形成了小孔。然而,这种方法可能并不总是适合于体内应用,因为跨细胞膜施加的高电压会引起细胞毒性[129],尽管体内CRISPR / Cas9应用不可能电穿孔。当sgRNA和Cas9以RNP复合物的形式传递时,电穿孔显示植物原生质体中脱靶突变的数量很少[130]。与脂质体DNA转染相比,通过脂质体介导的转染递送RNP复合物显示出脱靶突变的最小化[90]。
脂质纳米颗粒是将不同分子转移至靶细胞的普遍存在的载体。它通常用于装载在阳离子脂质体内的核酸递送,阳离子脂质体可以轻松地穿过靶细胞的细胞膜。由于Cas9和sgRNA由于它们的阴离子特性而保持在一起,因此以RNP复合物形式提供的CRISPR / Cas9组件获得了更大的成功[131,132]。另一种递送方法使用囊泡(细胞来源的纳米囊泡)将Cas9和sgRNA作为RNP递送到靶细胞。由于存在RNP,因此不存在持续表达Cas9的风险(这会提高Cas9的浓度并提高脱靶编辑的风险)[133]。综述了不同转化方法对植物脱靶突变的影响[134]。最新开发的非病毒基因递送方法,使用生物材料的聚乙烯亚胺(PEI)磁性纳米颗粒(MNP)被证明是有用的,无毒且具有脱靶效应,被认为是CRSIR-Cas介导基因编辑系统的最佳策略[135] 。最近,研究人员发现,通过电穿孔或脂质体转染方法将小载体(3 kb)和大载体(15 kb)共同转染到人类癌细胞系中,转染效率提高了40%,细胞死亡降低了45%。 [136]。
六、缓解脱靶效应:基础编辑器
通常,基因组中会发生意外突变或脱靶效应,这是由于在基因敲除之前先用DSB进行NHEJ,而在敲入之前则进行HDR。 最强大的工具可能是没有DSB的基因组编辑。 最近,已经开发了一种新的基因组编辑技术用于碱基编辑,该技术可以在不引入DSB的情况下改变基因组中的特定核苷酸[111,137,138]。 碱基编辑技术包括dCas9,脱氨酶(催化碱基修饰酶)和sgRNA。 与HDR相比,这些基础编辑工具已显示出显着的基因编辑效率。 碱基编辑器比Cas核酸酶更有效地编辑静态细胞的DNA,而Cas核酸酶则需要内源性DNA修复机制,而这种机制在非分裂细胞中是无效的[66]。 胞嘧啶基本编辑器(CBE)和胸腺嘧啶基本编辑器是开发的两类基本编辑器,它们可以分别将C / G更改为T / A,将A / T更改为G / C。
6.1 胞嘧啶碱基编辑器(CBE)
Cas核酸酶,sgRNA和AID / APOBEC胞苷脱氨酶是CBE的主要成分。在DNA中,CBE通过两种酶APOBEC(载脂蛋白B mRNA编辑型催化多肽样)和AID(激活诱导的胞苷脱氨酶)催化的胞嘧啶(C)水解脱氨反应生成胸腺嘧啶碱基(T)[139]。第一代CBE(BE1)是大鼠APOBEC与dCas的融合体,它容易因D10A和H840A突变而失活,并且能够将胞嘧啶转化为胸腺嘧啶(在sgRNA的PAM位点之间12-16范围内)。第二代CBE(BE2)是通过在BE1中添加尿嘧啶DNA糖基化酶抑制剂(UGI)形成的,从而将胞嘧啶碱基的功效提高了三倍[140]。为了进一步提高碱基编辑器的编辑效率,第三代碱基编辑器(BE3)是通过结合Cas9n(被突变D10A灭活以在靶链上形成缺口),胞苷脱氨酶和UGI来开发的,它们的编辑效率是后者的六倍。 BE2。由于BE3相对较少引起脱靶效应,因此在动物(小鼠),细菌和植物细胞中得到了广泛的应用,以编辑细胞的基因组成。为了更好地抑制内源性碱基切除修复,将另一个UGI副本和BE3融合以开发第四代碱基编辑器(BE4)。与BE3相比,BE4表现出的编辑效率更高。另一个关键因素是DNA甲基化会抑制碱基编辑效率。为基础编辑器开发的人类hA3A衍生的BE系统(hA3A–BE3)在高度甲基化的DNA区域显示出最大的编辑效率[141]。
6.2腺嘌呤碱基编辑者(ABE)
为将腺苷(A)更改为鸟苷(G)而创建的腺嘌呤基础编辑器(ABE)。基于大肠杆菌TadA(ecTadA)酶开发了一系列ABE。 ABE 7.1到7.10旨在提高目标上的活动并降低目标外的影响[111]。通过核定位产生的ABE-max降低了脱靶活动[142]。最近,新开发的基础编辑器ABE8e比ABE 7.10的目标活动增加了590倍[143]。
6.3 DNA和RNA脱靶突变
最近,在稻米和小鼠胚胎中检测到了整个基因组的许多脱靶突变,其原始频率分别是原始CBE BE3引起的,平均频率为5.3×10-7 / bp和5×10-8 / bp。[56,144]。过表达的BE3和ABE诱导脱靶RNA突变,其是sgRNA独立的,例如,由rAPOBEC1和TadA-TadA *引起的脱靶[56,145]。需要优化rAPOBEC1和TadA-TadA *以减少意外突变。 rAPOBEC1中引入的突变(R33A或R33A / K34A)称为SECURE(选择性阻止有害RNA编辑),显示RNA脱靶活性显着降低[145]。通过点突变(E59A)使ecTadA或ecTadA *失活,从而降低了RNA脱靶效应。为了提高特异性,通过改变特定的三个残基来提高ecTadA *的活性,从而降低了意外的RNA脱靶效率[146]。最近,在ecTadA中引入了单基因修饰(D53E或F148A)以开发可显着降低RNA脱靶的ecTadA *(ecTadA突变体)[147]。
6.4 高效的基础编辑交付
碱基编辑器的一个局限性是在体内向靶组织的递送-相对于质粒递送系统,碱基编辑器的核糖核蛋白(RNP)递送效率更高。因此,应谨慎考虑不同的投放策略,以通过控制曝光时间来减少意外编辑[148]。如前所述,AAV递送载体是一种流行的体内基因治疗方法[149]。包装容量限制了AAV的交付,并且碱基编辑器(5.2 kb)的大小无法使用Cas核酸酶将其包装在AAV中。最近,开发了一种转拼实习生方法,用于体内递送CBE和ABE,可在骨骼肌(9%),心脏(20%),视网膜(38%),肝脏(38%)和老鼠的大脑(约占未分类皮质组织的59%)[150]。
6.5 广泛的PAM网站基础编辑 Broader PAM Sites Base Editors
为了拓宽PAM识别位点,许多研究小组已经用各种工程核酸酶(例如KKH SaCas9,EQR,VRER,SaCas9,VQR,xCas9和SpCas9-NG)取代了BE3的spCas9,它们识别了基因组中的不同PAM位点[113,114,151,152 ]。 通过将nCas9替换为ABE7.10中的nXCas9,开发了许多类型的ABE,xABE扩展了包含GAT,GAA和NG PAM位点的基因组靶区域。 所有提到的基本编辑器都旨在识别G / C丰富的PAM sites。 通过将大鼠APOBEC1与非催化性Cpf1核酸酶融合,开发了“基于CRISPR-Cpf1的BE”来克服这一限制,该酶识别人细胞中相对较少的意料不到的修饰的富TPAM位点[153]。
七、减轻偏离目标的影响:主要编辑 Mitigation of Off-Target Effects: Prime Editing
最近,通过结合编程的逆转录酶与主要编辑gRNA(pegRNA)和Cas切口酶核酸酶的结合,开发了一种新的基因编辑方法(Prime编辑),该酶可以编辑或“搜索和替换”哺乳动物细胞中的碱基而不会产生双链断裂和DNA供体模板,附带损害更少。 Prime编辑(PE)涵盖了BE的局限性,BE可以有效地安装四个过渡突变(C到T或G到A,A到G和T到C)。但是,Prime编辑可以在基因组中安装所有12种可能的过渡变化(C / A,C / G,G / C,G / T,A / C,A / T,T / A和T / G)。 BE要求目标站点在特定位置编辑PAM。这就是为什么在“编辑窗口”中出现许多胞嘧啶或腺嘌呤碱基,或者相对于目标编辑而言,PAM位置缺乏15±2的情况,才会发生不需要的旁观者突变的原因。当旁观者编辑不可接受或目标站点缺少定位的PAM时,PE可以进行编辑。突变已得到纠正,从而导致镰状细胞性贫血和塔伊-萨克斯病(Tay-Sachs disease),脱靶编辑最少,PE可以纠正高达89%的已知突变,从而引起致病突变[154]。原始编辑是一项过早的技术。 NHEJ可以修复一些场地;这可以视为其他类型的脱靶目标。然而,需要对动植物模型的主要编辑进行更多的研究,以将其转移到治疗性基因编辑中。
八、缓解脱靶效应:抗CRISPR蛋白
抗CRISPR(Acr)蛋白是天然的CRISPR / Cas系统抑制剂,由各种移动遗传元件(MGE)编码,可在各个阶段抑制CRISPR-Cas的免疫功能。已发现多达45种Acr蛋白,其中“ AcrIIA4”具有保护细胞免受编辑的潜力[154]。 Shin与同事发现,通过调节AcrIIA4或Cas9加入检测的时间,AcrIIA4可以将脱靶修饰降低四倍,而不会降低靶上效应[155]。
九、结论与未来展望
CRISPR / Cas9能够以前所未有的精度修饰基因组的成功,可以归因于它的准确性,效率,成本效益以及比传统基因编辑工具(ZFN和TALEN)更易于使用。但是,CRISPR / Cas工具会在基因组水平上造成有害的脱靶效应。报道了各种技术,包括不同的生物信息学方法,例如用于脱靶突变的计算机检测以及改善的脱靶效率以改善脱靶效应。选择合适的脱靶检测工具,例如具有预测性的靶上和脱靶位点的偏倚和无偏,比CRISPR传递系统更为关键。
最优选的脱靶检测有偏和无偏方法分别是 Elevation 和GUIDE-seq。
在gRNA修饰中,截短的sgRNA规定了减少脱靶效应的简单方法,并且在大多数情况下,基于RNP的递送适用于获得较高的脱靶活性。此外,选择Cas变体对于减少取决于实验性质的脱靶效应也至关重要。
此外,选择Cas变体对于减少脱靶效应也很关键。研究人员正在努力创造工程化的Cas9变体和新的基因靶向技术,从而在哺乳动物细胞中产生可忽略的脱靶效应,从而改善治疗性基因编辑或基因组手术。当前开发的主要编辑工具具有在人类细胞中产生最小脱靶效应的遗传疾病治疗方面的未来前景,但是脱靶效应也限制了Prime编辑应用程序。然而,需要进一步研究以开发超级CRISPR系统来治疗医疗保健系统中的遗传性疾病。
参考资料
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7407193/ 。 Cells. 2020 Jul; 9(7): 1608. Published online 2020 Jul 2. doi: 10.3390/cells9071608。 Latest Developed Strategies to Minimize the Off-Target Effects in CRISPR-Cas-Mediated Genome Editing
