【2.4】LNP-mRNA的非免疫疗法应用
一、简介
宿主免疫系统识别病毒感染并对其作出反应。先天免疫系统在抗病毒防御中的关键反应物是靶向病毒基因组 DNA 和 RNA 的模式识别受体 (PRR),例如单链 RNA (ssRNA) 和双链 RNA (dsRNA)。PRR 的激活导致信号转导级联反应,导致细胞因子的分泌和适应性免疫的发展。与病毒核酸类似,基于信使 (m)RNA 的疫苗和疗法通过基于 PRR 识别的相同机制激活免疫系统,综述见 [ 1 , 2 , 3 , 4 ]]。它们代表了一类新的药物,由合成的 mRNA 组成,它们被包装成各种类型的盾牌,保护 mRNA 免受核糖核酸酶 (RNase) 的侵害,并促进 mRNA 转运和导入靶细胞、组织和器官。
体外转录 (IVT) mRNA 编码的抗原(用于疫苗和免疫疗法应用)或感兴趣的蛋白质(用于作为蛋白质替代疗法或抗体生产的疗法)通常被封装到脂质纳米颗粒 (LNP) 中。在蛋白质替代疗法中,mRNA 被设计为编码感兴趣的细胞内或分泌蛋白质 [ 1 , 5]]。在典型情况下,蛋白质替代旨在恢复酶功能以治疗罕见的单基因疾病。
-
当 LNP 包裹的 mRNA 进入细胞质时,细胞翻译机制从 LNP 递送的 mRNA 基质中读取感兴趣的蛋白质。治疗性蛋白质以宿主细胞特异性方式进行翻译后修饰,这是与直接利用蛋白质给药的酶替代疗法 (ERT) 相比的主要优势之一 [ 5 ]。对于蛋白质替代疗法,mRNA 相对于蛋白质的其他优势是克服了大生物分子生产和降解方面的挑战,以及在 ERT 中传递细胞内和跨膜蛋白的困难 [ 6]]。mRNA 疗法的特点是相对快速、简单和廉价的生产 [ 1 ]。
-
与其他基于核酸的疗法(例如基于 DNA 的疫苗)相比,基于 mRNA 的疗法有几个优点:缺乏基因组整合、细胞质中的功能性以及不需要核靶向 [ 1 , 5 ]。
30 年前,Wolff 等人首次证明了 mRNA 技术基础的临床前研究。表明注射到小鼠体内的裸 IVT mRNA 可以被翻译 [ 7 ]。最近,许多用于传染病的 LNP-mRNA 疫苗、基于 mRNA 的癌症免疫疗法和几种 RNA 蛋白替代疗法进入临床试验 [ 5,8 ]。2020 年 12 月,BioNTech/Pfizer 和 Moderna 的针对 SARS-CoV-2 的 LNP-mRNA 疫苗在预防有症状的 COVID-19 的 3 期临床试验中被证明是高效和安全的,从而获得了紧急使用授权或有条件的营销授权在全球多个国家/地区,为结束 COVID-19 大流行带来了希望 [ 9 , 10 , 11 ]。最近,来自 CureVac 的 LNP-mRNA 也进入了 3 期临床试验,增加了针对 COVID-19 的 LNP-mRNA 管道的多样性 [ 12]]。来自关键初级研究的背景信息以及之前使用基于 mRNA 技术的 1 期和 2 期临床试验的经验是在 COVID 中快速设计和生产大量高效且安全的 LNP 配方 mRNA 疫苗的基础-19 大流行,为该领域的美好未来铺平了道路 [ 13 , 14 ]。LNP-mRNA 预防性疫苗和免疫治疗应用可以从 PRR 对免疫激活的辅助作用中整体受益 [ 15 , 16]]。
然而,基于 LNP-mRNA 的非免疫疗法应用通常需要长期重复全身给药、mRNA 的细胞特异性靶向、靶蛋白的高翻译,以及在没有免疫激活的情况下最大的安全性。这些应用类型,例如蛋白质替代疗法,需要进一步了解作用方式,并进一步最大限度地提高其功效和安全性。因此,虽然目前正在进行许多临床前研究,但只有少数基于 mRNA 的非免疫疗法候选药物已进入临床研究。本综述总结了 IVT mRNA、副产物和 LNP 诱导的免疫激活的基础知识,以及基于 RNA 的非免疫疗法应用的现状
二、IVT mRNA 和副产品诱导免疫激活
LNP-mRNA 疗法的 mRNA 成分是在体外转录反应过程中使用帽、核糖核苷酸和含有启动子的 DNA 模板以及识别该启动子的噬菌体 RNA 聚合酶合成产生的。体外转录的 mRNA 通常由帽结构、5’非翻译区 (5’UTR)、密码子优化的蛋白质编码或抗原序列、3’UTR 和 polyA 尾组成 [ 1 ]。IVT mRNA 被设计为类似于天然 mRNA,同时在翻译特性和药效学以及 mRNA 稳定性和安全性方面设计最大可能的好处。然而,IVT 反应成分和条件不仅会导致产生感兴趣的 mRNA,还会导致产生不同数量的免疫刺激副产物/污染物,例如 dsRNA [ 17], 18 , 19 ]。此外,必须确保不存在脂多糖 (LPS)/内毒素等污染物水平或低于公认的安全阈值。
LNP-mRNA 的免疫激活水平取决于给药途径、剂量、模型生物/患者的预先存在的免疫状态,以及 LNP-mRNA 的特征。要考虑的 LNP-mRNA 特征是:
- mRNA 修饰/序列/结构,
- mRNA 和 IVT 反应副产物/污染物的制造,
- 所用 LNP 的特征
免疫系统可以通过感知宿主 PRR(pattern recognition receptors) 的 RNA 产物和 IVT 反应的副产物来激活。目前已知的 PRR 主要有三种类型。Toll 样受体 (TLR) 主要存在于免疫细胞的内体区室中, 视黄酸诱导基因 I (RIG-I) 样受体 (RLR) 和 NOD 样受体 (NLR) 存在于免疫和非免疫细胞的细胞质中 [ 2 , 20]。PRRs 感应 RNA 触发信号转导级联反应,导致细胞因子分泌,最终可能导致免疫系统激活,在某些情况下甚至导致细胞死亡(图 1)。因此,PRRs 的 RNA 传感可能导致 LNP-mRNA 效力的降低和潜在的安全考虑,这对于非免疫原性 LNP-mRNA 应用特别感兴趣。以下部分通过概述富含尿苷 (U-rich) 的单链 mRNA 和不同类型的双链 RNA 的影响,总结了主要的免疫激活途径。

图1。 RNA诱导的免疫激活示意图
富含 U 的单链 mRNA 被 TLR7 和 TLR8 识别 [ 21 , 22 ]。它的识别导致 TLR 激活、通过骨髓分化初级反应基因 88 (MyD88) 衔接蛋白和肿瘤坏死因子受体相关因子 6 (TRAF 6) 进行信号转导,从而导致 IκB 激酶 (IKK) 复合物的激活,综述于2 , 23]。IKK 复合物激活 NF-κB 转录因子 (TF),后者转移到细胞核,在那里诱导 I 型干扰素的表达,如 IFN-α 和 IFN-β、肿瘤坏死因子-α (TNF-α)、白细胞介素- 6 (IL-6) 和白细胞介素 12 (IL-12)。这会触发促炎反应以及干扰素的自分泌和旁分泌。干扰素然后激活 Janus 激酶 (JAK)-信号转导和转录激活因子 (STAT) (JAK-STAT) 通路,导致 IFN 刺激的基因因子 3 (ISGF-3) 的形成,进而转移到细胞核,进一步激活数百个 IFN 刺激的基因(信号级联在 [ 2 , 23 , 24])。这些基因包括 PRRs 和 TFs,进一步放大信号并导致免疫系统激活的增强。
此外,ISGF-3 激活许多具有抗病毒/抗 RNA 反应功能的基因,例如 dsRNA 依赖性蛋白激酶 (PKR)、2'-5'-寡腺苷酸合成酶 (OAS) 和 RNA 特异性腺苷脱氨酶 (ADAR)(图 1)(综述于 [ 2 , 20 ])。激活的PKR可以磷酸化eIF2α转录起始因子,导致IKK复合体的翻译受抑制和刺激,从而放大先天免疫信号或导致细胞凋亡[ 25 ]。双链 RNA 激活的 OAS 从 ATP 合成 2'-5'-连接的寡腺苷酸 (2-5A),激活 RNAse L,导致 ssRNA 的裂解和降解 [ 26]]。由 RNase L 切割的 mRNA 部分结合并激活 PRR,进一步放大 I 型 IFN 环。
ISGF-3 基因激活的另一个重要机制包括增加作用于 RNA (ADAR) 酶的腺苷脱氨酶。ADAR1 具有多种功能。
- 首先,ADAR1 靶向 mRNA 分子的双链区域,将腺苷 (A) 脱氨基为肌苷 (I),从而引入 I:U 错配,从而导致 mRNA 不稳定 [ 27 ]。引入的错配可能会导致编码蛋白的氨基酸序列发生变化,从而导致 mRNA 的翻译效率降低 [ 28 , 29 ]。
- ADAR1 的第二个重要功能是其在抑制干扰素信号传导中的作用 [ 30 ]。利迪科特等人。生成具有编辑缺陷敲入突变的小鼠 [ 31]。有趣的是,当同时删除黑色素瘤分化相关蛋白 5 (MDA5) 时,可以挽救这些小鼠的胚胎死亡和表型。在这项研究中,作者建立了 ADAR1 在编辑内源性 RNA 和阻止其被 MDA5 感知为非自身方面的生理功能,从而抑制 IFN 反应 [ 31 ]。
- 此外,另一项研究报告称,当同时删除 RNase L 时,人类细胞中 ADAR1 缺失的致死表型得以挽救 [ 32 ]。这表明 ADAR1 还阻断了 OAS-RNase L 通路 [ 32 , 33]。虽然几项体外研究表明 ADAR1 也能阻断 RIG-I 的激活,但这无法在体内得到证实,因为编辑缺陷的小鼠无法通过同时删除 RIG-I 来拯救,需要进一步研究([ 33 ] 中的综述) )。
总之,ADAR 在平衡免疫激活和自我耐受方面的重要作用已经确立 [ 31 , 33 ]。虽然富含 U 的 ssRNA 被 TLR7 和 TLR8 感知,但 dsRNA 副产物/污染物通常在巨噬细胞的内体区室中被 TLR3 感知 [ 34 , 35 ](图 1))。TLR3 进一步分别激活含有 TIR 结构域的接头诱导干扰素-β (TRIF) 和 TNF 受体相关因子 3 (TRAF3)、TANK 结合激酶 1 (TBK1) 和 IKKε。随后激活干扰素调节因子 (IRF) 3 和 7,即促进 I 型干扰素产生的转录因子,最终通过已经描述的途径引起信号放大和免疫系统激活(见 [ 2 , 23 ]) .
在免疫和非免疫细胞中,dsRNA 被 RLRs 和 NLRs 识别(综述于 [ 20 , 36 ])。RIG-I 是识别 5’ppp dsRNA 和 5’pp dsRNA [ 37 ]的 RLR 。这种识别需要携带 5’ppp 的核苷的碱基配对及其缺乏 N1-2’O-甲基化 [ 38 , 39 ]。长 dsRNA(大于 1kb)被 MDA5 RLR 识别 [ 40 , 41 ]。在 RIG-I 和 MDA5 检测 dsRNA 的两种情况下,信号被转移到线粒体抗病毒信号蛋白 (MAVS) 并导致 TBK1 和 IKKξ 的激活 [ 42]。dsRNA 也可以被 NOD 样受体家族 (NLR) 的两个成员识别:激活的 NLR 家族 pyrin 结构域包含 1 (NLRP1) 或 NLRP3,它与包含 CARD (ASC) 的凋亡相关斑点样蛋白一起和 caspase 1,构建炎症小体,导致 IL-1β 和 IL-18 细胞因子的蛋白水解成熟和炎症 [ 43 , 44 ]。此外,活化的半胱天冬酶 1 会裂解 Gasdermin D (GSDMD),导致细胞焦亡,这是一种高度炎症的细胞凋亡形式 [ 45 ]。有趣的是,Bauernfried 等人。发现人类 NLRP1,而不是鼠 NLRP1B,可以被 dsRNA 免疫沉淀 [ 44 ]。
在真核生物中,mRNA 的 5' 端由 m7GpppNm (cap1) 或 m7GpppN1mN2m (cap2) 组成,其中 Nm 是 2'-O-甲基化核苷酸。cap0 (m7GpppN) 缺乏甲基化也可导致 RIG-I 激活,而使用 cap1 或 cap2 会降低通过 RNA 传感器 RIG-I 和 MDA5 诱导细胞因子,从而提高安全性 [ 41 , 46 ]。此外,虽然干扰素 (IFN) 诱导的四肽重复序列 (IFIT) 蛋白 1 (IFIT1)(一种已知的翻译抑制剂)与 eIF4E 竞争结合 cap0,但它对 cap1 和 cap2 的亲和力显着降低 [ 47 , 48 ]。
上述机制表明,含有未优化 mRNA 的粗制、未纯化的 IVT 反应可导致免疫反应的增强和潜在的过度反应,这可能导致翻译减少、RNA 降解和甚至靶细胞凋亡。因此,mRNA 优化和纯化是开发 LNP-mRNA 的关键步骤,具有增强的药理学和有益安全性,适用于基于 mRNA 的非免疫治疗应用。
三、 LNP 诱导免疫激活
LNP-mRNA 免疫激活的另一个原因是 mRNA 制剂的特异性。虽然脂质体和脂质复合物是最早应用于 mRNA 的制剂,但最近,脂质纳米颗粒 (LNP) 制剂被广泛使用 [ 49 , 50 ]。LNP 最初是为 siRNA 的配方开发的 [ 51 , 52 ]。2018 年,第一个含有 LNP 的药物 Onpattro ®,即用于治疗转甲状腺素蛋白介导的淀粉样变性的 LNP-siRNA 孤儿药获得批准 [ 53 , 54 ]。
LNP 通常由四种成分组成:
- 可电离的阳离子脂质、
- 结构脂质、
- 胆固醇
- 隐形涂层脂质(图 2))。
氨基或可离子化的阳离子脂质是 pH 可滴定的脂质,由于它们在配制过程中的酸性条件下带正电荷,因此允许截留带负电荷的 mRNA。含有可电离阳离子脂质的 LNP-mRNA 不带电,但在低 pH 值的内体中质子化,并通过与带负电的内体脂质双层相互作用帮助内体释放 mRNA(在 [ 55 , 56 ] 中综述)。虽然结构脂质允许维持颗粒结构,但胆固醇增强颗粒稳定性,从而最有可能影响 LNP 形态和 mRNA 传递 [ 57 , 58]。隐形涂层脂质如聚乙二醇 (PEG)-脂质或聚肌氨酸 (pSar) 能够控制 LNP-mRNA 的理化特性(例如,粒径和结构)并影响颗粒的循环半衰期 [ 56,59 , 60 ]。
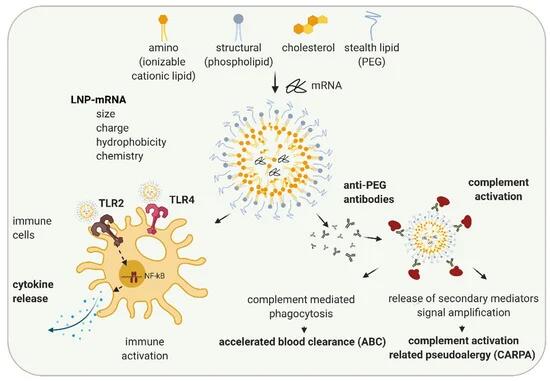
图 2. LNP 诱导的免疫激活示意图
许多研究已经检查了构效关系,并揭示了 LNP 的特性,例如粒径、电荷、疏水性、组分摩尔分数和表面化学性质,会影响 LNP 与免疫系统的相互作用 [ 61 , 62 , 63 ]。根据它们的特性,的LNPs可引起各种体内免疫作用:免疫细胞,炎症,适应性免疫应答的活化,并且在一些情况下,补体活化和补体激活有关的pseudoallergy(CARPA)(图2)[ 64,65,66 ]。阳离子脂质纳米载体被位于巨噬细胞和其他细胞表面的 TLR2 和 TLR4 识别。67,68,69 ]。LNP-TLR 的识别通过类似的途径触发细胞因子和趋化因子的分泌,如之前讨论的 RNA-TLR 识别。艾布拉姆斯等人。显示在静脉 (iv) 应用 0.5–8 mg/kg LNP 后,有或没有 siRNA小鼠,表明 LNP 成分主要负责观察到的先天免疫反应 [ 70 ]。在同一项研究中,观察到 91 个测试的促炎基因中至少三分之一的上调超过 10 倍,表明存在炎症。阳离子脂质纳米载体还可以激活炎性体的 NLRP3 成分并导致炎症 [ 67 ]。
在大多数情况下,目前使用的 LNP 含有 PEG 脂质。PEG 脂质在空间上屏蔽了 LNP 与其他脂质颗粒或血液成分的相互作用,从而降低了 LNP 的自我聚集、调理作用或吞噬作用 [ 71 ]。PEG广泛用于化妆品和食品工业。PEG 的免疫原性自 1983 年就已为人所知,当时注射 PEG 化蛋白会导致兔体内产生抗 PEG 抗体 [ 72 ]。PEG 在不同行业的广泛使用导致健康志愿者抗 PEG 抗体阳性的百分比增加,从 1984 年的 0.2% 增加到 2016 年的约 40%(综述于 [ 65 , 73])。最近,许多研究表明,在动物研究和患者中会形成抗 PEG IgM,并在较低程度上形成针对 LNP 和含有 PEG 脂质的脂质体的 IgG 抗体 [ 65 ]。抗 PEG 抗体会阻碍 LNP-mRNA 的功效,尤其是在重复给药时(如非免疫疗法应用中所要求的),并可能导致安全风险增加 [ 73 ]。加速血液清除 (ABC) 现象是在 Dams 等人之后确立的一个术语。揭示第二剂 PEG-脂质体从大鼠和恒河猴的血液中迅速清除,而第一剂在血液中表现出长循环 [ 74 ]。ABC 现象取决于应用程序之间的时间间隔(在 [ 75])。例如,虽然在大多数研究中,间隔 7 天的聚乙二醇化纳米颗粒会在第二次给药后产生强 ABC,但间隔 28 天会导致清除率显着降低 [ 75 ]。除了注射之间的时间间隔,影响ABC现象,例如,动物物种,化学和LNP的物理化学性质,并在包封药物依赖大量其他因素建立(综述[ 65,75,76 ])。
在最近对猪的研究中,Kozma 等人。研究了 PEG 包被的脂质体如何影响超敏反应 (HSR),并发现抗 PEG IgM 抗体与 PEG 化脂质体的结合可导致补体激活和 CARPA [ 77 ]。CARPA 代表输液反应的主要机制,其中假性过敏性休克是最坏的结果。然而,输注反应的发展高度依赖于 PEG 特性以及免疫系统变异性和个人先前的 PEG 暴露。目前,已有超过 15 种药物具有突出的例子,例如 Doxil ®、Onpattro ®、BioNTech/Pfizer COVID-19疫苗(COMIRNATY ®)和 MODERNA COVID-19 VACCINE ®含有 PEG,已获得监管机构的批准或获得紧急授权 [ 64 ]。这些药物正在使用中,因为它们应用的好处大大超过了潜在的安全问题,其中大部分来自输液反应。虽然通常情况下,输液反应会引起轻微的副作用(例如头痛和肌肉疼痛),不需要进一步治疗,但在极少数情况下,它们会引起过敏反应并需要用肾上腺素治疗。需要进一步研究并更好地了解可能由 LNP-mRNA 引起的免疫激活和偶发性过敏反应的机制。
四、LNP-mRNA 在 RNA 蛋白替代和其他非免疫疗法应用中的应用
虽然提高药物疗效、改善临床结果以及降低剂量和成本是临床前研究的共同目标,但安全性是先决条件。通过减少 LNP-mRNA 应用的潜在副作用实现最大安全性对于 RNA 蛋白替代疗法至关重要,包括罕见疾病和其他非免疫疗法方法。这些基于 LNP-mRNA 的应用通常需要在较长的时间段内(例如,直到器官移植)或终生重复给药。此外,需要引入相对较大的剂量,并且在某些情况下(例如用于罕见遗传疾病的应用),通常需要在生命早期针对已经患病的器官。本文总结了当前的临床前和临床基于 RNA 的蛋白质替代疗法 (RPRT)。78 , 79 ]。
与疫苗和免疫疗法应用相比,LNP-mRNA 非免疫疗法应用需要更大量的临床前测试,并且非常注重安全性。基于先前讨论的 LNP-mRNA 免疫激活机制,此类研究的最佳临床前测试将包括:(
- 增加 LNP-mRNA 剂量与细胞因子和趋化因子分泌的相关性,
- 补体激活,
- 重复给药抗药物抗体检查的影响,
- 急性肝毒性标志物和潜在的脂质积累
- 靶器官的组织病理学。
不幸的是,目前关于 LNP-mRNA 非免疫疗法临床前研究的文献主要集中在小鼠模型中的药物功效,并且提供的安全性数据有限(表 1)。列出的涵盖最近发表的关于 RNA 蛋白替代研究的临床前研究表明,这仍然是一个相对年轻的领域。科曼等人。是第一个在 2011 年在 RNA 蛋白替代疗法的背景下应用编码表面活性蛋白 B (SP-B) 和促红细胞生成素的裸修饰 mRNA [ 80 ]。然而,第一项使用 LNP 配制的 mRNA 进行 RPRT 的研究仅在 2016 年发表(表 1)。在该研究中,Nabhan 等人。应用编码人 frataxin 的 LNP-mRNA 作为治疗弗里德赖希共济失调的潜在疗法 [ 81]]。大多数研究最近才发表,最近 3-4 年(表 1)。尽管所有这些研究都显示了在引入相应的 LNP-mRNA 后产生的治疗相关蛋白量,但在列出的 20 项临床前研究中,只有不到一半涉及安全性问题。
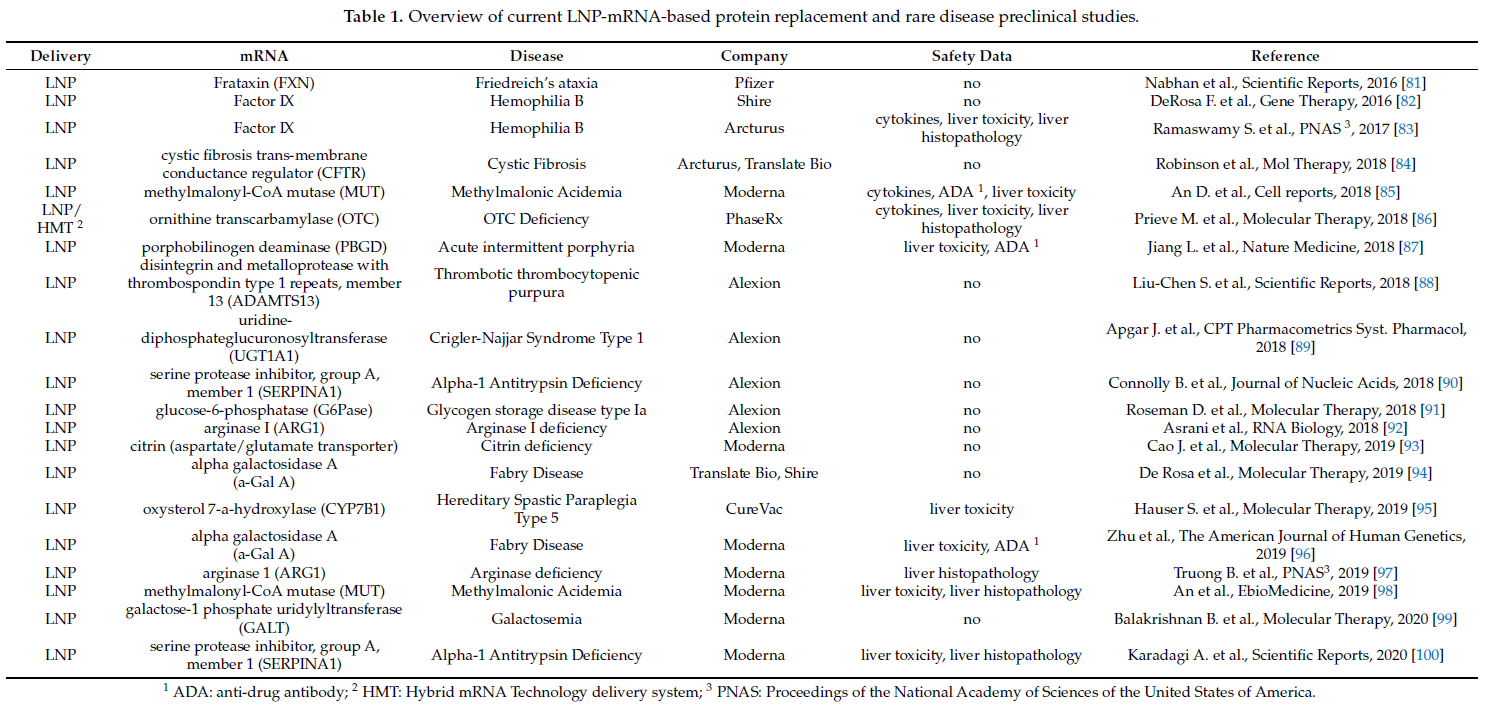
传统上,体内毒理学研究包括通过测量临床化学标志物(例如丙氨酸转氨酶 (ALT) 和天冬氨酸转氨酶 (AST))以及免疫和/或靶器官的组织病理学来检查肝毒性。根据药物应用途径和 LNP 的特异性,LNP-mRNA 疗法可以靶向不同的器官,肝脏是最常靶向的器官。与表 1 中列出的大多数研究一致,传统上通过肝毒性和组织病理学研究来检查安全性。然而,虽然传统的安全性研究可以检测到免疫系统的严重损伤,但它们无法提供有关中度和低度免疫毒性的信息。因此,需要针对细胞因子和趋化因子分泌、ADA 以及补体激活进行更多研究,以预测潜在的安全问题,例如免疫激活或损伤。 细胞因子和趋化因子是免疫毒性的生物标志物 [ 101 ]。它们在调节免疫反应方面具有多种功能,并且是输液反应的已知原因,其特征可以是发烧、低血压、呕吐、寒战、头痛、恶心、肌肉疼痛等 [ 102 , 103]]。
- 细胞因子,即干扰素 (IFN) γ、白细胞介素 (IL)-1、IL-2、IL-6、IL-1β 和肿瘤坏死因子 (TNF),通常会导致促炎作用。IL-1 和 IL-6 引起发烧,TNFα 低血压和 IFNγ 激活巨噬细胞,进一步促进细胞因子/趋化因子的分泌。
- 趋化因子,例如干扰素-γ 诱导蛋白 10 kD、CXCL10 (IP-10)、巨噬细胞炎症蛋白-1 α (MIP-1α) 或 MIP-1 Beta (MIP-1β) 和单核细胞趋化蛋白-1 (MCP- 1) 在白细胞募集和运输中发挥作用,并且在失调时可能在过度炎症中起作用,如 [ 103 ] 中所述。
有趣的是,健康志愿者血清中细胞因子和趋化因子的生理水平取决于年龄并表现出个体差异[ 104 ]。虽然某些细胞因子/趋化因子(例如 IL-2)在整个群体中显示出相对恒定的水平,但其他一些(例如 IP-10 和 MCP-1)在个体之间会显示出 3-4 倍的差异 [ 104 ]。健康受试者免疫系统的这些基础生理差异可能导致对候选药物的反应多样化。虽然大多数患者不会发生输液反应,但有些患者可能会出现轻度至中度的不良反应。在极少数情况下,可能会发生由称为细胞因子风暴的大量细胞因子释放引起的危及生命的情况 [ 103 ]。 对于 LNP-mRNA 候选药物,美国食品和药物管理局 (FDA) 建议在人全血或外周血单核细胞 (PBMC) 中进行临床前体外研究和体内动物研究,以测试广泛的细胞因子/趋化因子组合,包括 IL-2、IL- 6、IFNγ 和 TNFα,以便绘制与输注相关的毒性加剧的可能性 [ 105 ]。有趣的是,FDA 还建议,无论动物研究的阴性结果如何,都应将人体细胞体外细胞活化的迹象作为临床潜在毒性的预测指标 [ 105]]。之所以有这样的说法,源于2006年,当时采用单克隆抗体TGN1412的疗法通过了包括食蟹猴研究在内的安全性临床前试验,但在所有6名受试者用药后约1小时内发生细胞因子风暴,导致多器官功能衰竭。 1 期临床研究中的两名人类受试者 [ 106 ]。后来发现,在所有临床前动物模型中都缺乏一种特定的人类T细胞受体,导致了这种对药物安全性的误判。将人 PBMC 添加到固定化 mAb 或与内皮细胞共培养,然后用 mAb 处理的体外研究有助于通过检测 TNFα、IL-2、IL-6、IL-8 和 IFNγ 细胞因子来预测结果释放 [ 106 ]。
表 2概述了在当前 RNA 蛋白替代临床前研究文献中检查细胞因子/趋化因子分泌的少数研究。在评估临床前细胞因子和趋化因子分泌数据时需要考虑多个方面:
- 使用的动物模型和体外人体数据的可用性;
- 应用剂量和体内研究的给药途径;
- 单次或重复给药后的评价,包括评价时间;
- 测试的细胞因子/趋化因子面板;
- 使用的测定法。
在所有列出的研究中,仅测试了体内小鼠样本,而缺乏人体体外数据。此外,仅获得至少第三次重复给药后的结果,而未检查单次给药的效果。在 An 等人的研究中,85 ]。拉马斯瓦米等人。和普里夫等人。在应用相对较高的 LNP-mRNA 剂量后 3-7 小时测试细胞因子,发现粒细胞集落刺激因子 (G-CSF)、MCP-1、MIP-1β、IL-6、RANTES 和 IL 的显着分泌-12 (表 2 ) [ 83 , 86 ]。

除了此处总结的疾病相关研究外,只有少数其他 LNP-mRNA 研究更详细地检查了安全性。塞迪克等人。检查了在大鼠和非人类灵长类动物 (NHP) 中编码促红细胞生成素 (EPO) 的 LNP-mRNA 的安全性 [ 107 ]。
- 在大鼠中,每周一次或两次静脉注射 0.3 mg/kg 后,IP-10 在给药后 6 小时和 24 小时升高,而没有观察到 IL-6、TNFα 和 IFNα 的变化。
- 在猴子中,当应用相同剂量时,未检测到测试细胞因子/趋化因子的变化。
- 在同一研究中,在猴子中发现 C3a 和 C5b-9 升高,并且随着重复给药的幅度增加,而在大鼠中未观察到补体激活 [ 107]]。
在测试 LNP 的新型氨基脂质成分时,Sabnis 等人。还进行了毒理学评估,包括在第 1 天和第 29 天后 2 小时、6 小时和 25 小时注射 1 mg/kg LNP-mRNA 的食蟹猴的肝脏毒理学、补体和 MCP-1 血清浓度 [ 108 ]。作者没有发现肝毒性或补体激活的迹象,而在第 1 天应用后 2 小时观察到 MCP-1 略有增加。这种影响在第 29 天变得可以忽略不计。不幸的是,安全性研究仅针对最有效的新型氨基脂质 LNP5 显示,而尚不清楚它们如何与其他测试脂质进行比较,包括之前用于 LNP-siRNA 批准药物的对照 MC3 脂质,Onpattro ® [ 53]。马格里等人。分析小鼠血浆细胞因子:激活后受调节、正常 T 细胞表达和分泌 (RANTES)、角质形成细胞衍生的趋化因子 (KC)、IL-6、IP-10、IL-1β、TNFα、MCP-1 和 IFNγ,5静脉注射 1.5 µg 含有促红细胞生成素 mRNA 的 LNP 后 h 和 24 小时 [ 109 ]。有趣的是,在这项研究中,作者发现注射 LNP-mRNA 时细胞因子浓度更高,与注射内吞 LNP 分泌后自然形成的细胞外囊泡 (endo-EV-mRNAs) 中相同的 mRNA 相比。 mRNA [ 109 ]。最近,Noguiera 等人。比较了具有不同隐形涂层脂质的 LNP 的安全性:聚乙二醇 (PEG)-脂质和聚肌氨酸 (pSar) [ 59]。作者测试了 IL-8、IL-6、IL1-β、IFN-γ、TNF-α、IL-2、IL-10、IL-4、IL-5 和粒细胞-巨噬细胞集落刺激因子 (GM- CSF),发现与用 1,2-Dimyristoyl-rac-glycero-3-methylpolyoxyethylene (PEG-DMG) 制备的 LNP 相比,用 pSar23 配制的 LNP 显示出降低的细胞因子谱。在同一研究中,在最后一次注射后 4 周和 48 小时内每周多次注射的小鼠模型中检测了肝脏毒理学标志物 AST、ALT、laktat-脱氢酶 (LDH) 和总胆红素,其中检测到可比或有利的安全性特征含有 LNP 的 pSar [ 59]。此外,作者将 pSar23 和 PEG LNP 与人血清一起孵育,发现与 PEG LNP 相比,当使用高剂量 pSar23 时,C3a 补体水平的诱导较低,表明与 pSar 配制的 LNP 的毒性较低 [ 59 ]。
虽然这些安全性研究提供的关于应用 LNP-mRNA 药物免疫激活的数据有限,但显然需要额外的数据来解决以下问题:模型系统和检测的比较,以及建立最佳预测面板、新的生物标志物、和最佳测试时间。此外,更好地了解细胞因子/趋化因子临床前测量的范围和截止值,并绘制出人类供体之间的差异,将共同提高临床前研究的预测价值。
目前,只有少数正在进行的用于 RNA 蛋白替代的 LNP-mRNA 临床研究(表 3)。从 2018 年至 2020 年开始的研究中,有两项研究被终止:MRT5201 因计划终止而 mRNA-3704 因商业决策而终止。非处方药缺乏症候选药物 ARCT-810 的 1 期临床试验已在健康成人中成功完成,目前正在招募 1/2 期 OTCD 研究。同样,检查 MRT5005囊性纤维化候选药物的 NCT03375047 研究目前正在 1/2 期招募。
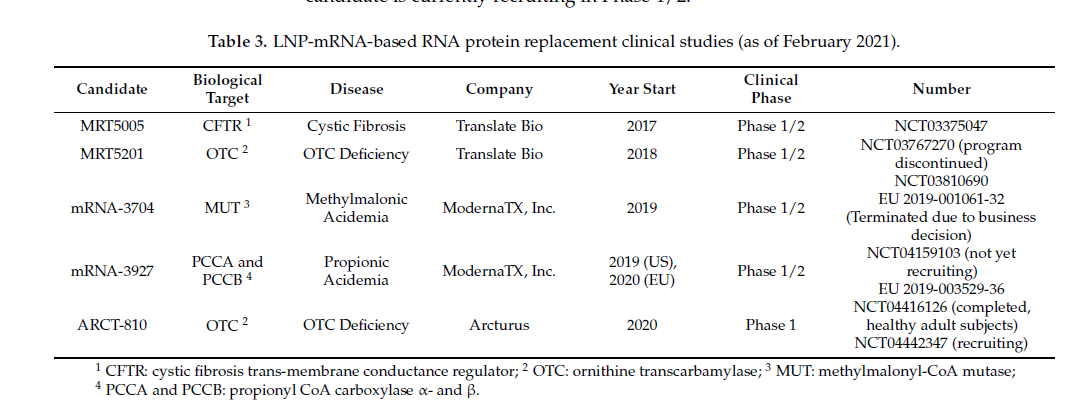
此外,除了此处讨论的临床研究外,Arcturus、Translate Bio、CureVac、BioNTech/Genevant 和 Moderna 等公司还有多种基于 LNP-mRNA 的 RPRT/罕见疾病候选药物在研(表 4)。随着更多 LNP-mRNA 候选药物进入临床,检查临床前数据和临床数据之间的相关性将成为可能。这将允许更好地定义临床前监管指南。最后,这也将有助于更好地理解和使用临床前模型的预测价值,以进一步提高 LNP-mRNA 药物的疗效和安全性,尤其是对于非免疫原性 LNP-mRNA 应用。

五、提高 LNP-mRNA 应用的有效性和安全性
LNP-mRNA 候选药物的 mRNA 和 LNP 成分的创新及其生产方法的改进是这个相对年轻的治疗领域的标志。这种持续的发展是 LNP-mRNA 适用性的巨大治疗潜力和预期增长的基础,不仅适用于疫苗和免疫治疗,而且适用于更具挑战性的应用,如 RNA 蛋白替代和单克隆抗体治疗。mRNA层面的创新包括
- RNA核苷修饰,
- 序列和结构优化,
- IVT mRNA的生产和纯化方法(图3)。
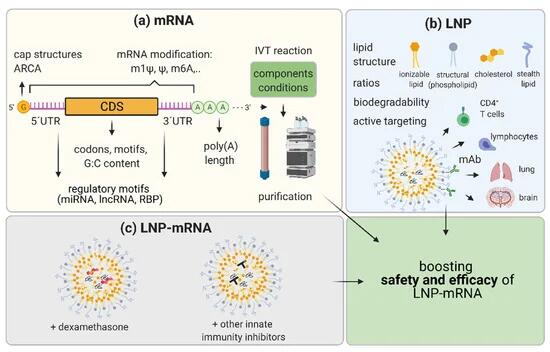
图 3. 表示提高 LNP-mRNA 功效和安全性的策略。(一个) mRNA 优化包括 (1) 使用不同的 mRNA 核苷修饰;(2) 通过改变帽结构和/或利用抗反向帽类似物 (ARCA) 来增加 mRNA 的加帽;(3) 选择最有效的 UTR:通过避免或利用微 (mi)RNA、长链非编码 (lnc)RNA 和 RNA 结合蛋白 (RBP) 识别的调控基序来优化 5’UTR 和 3’UTR;(4) 通过使用更频繁的密码子、避免特定基序和改变 G:C 含量来优化编码序列 (CDS);(5) 改变体外转录 (IVT) 反应的成分和条件,以减少副产物并提高产量,并为各种应用开发最佳纯化方案。(乙) 脂质纳米颗粒 (LNP) 优化可能包括 (1) 改变 LNP 组分之间的化学和摩尔比,重点关注可电离脂质和隐形脂质的可生物降解性和新颖性;(2) 主动靶向其他组织,例如使用单克隆抗体 (mAb) 识别 T 细胞、淋巴细胞和脑或肺血管系统上的特定分子。(c)此外,为了实现更高的功效和最大的安全性,可以将分子作为皮质类固醇(地塞米松)或其他已知抑制先天免疫的小分子与 LNP-mRNA 候选疗法共同配制。优化 mRNA 和 LNP 作为成分并将 LNP-mRNA 与免疫抑制剂相结合旨在提高 LNP-mRNA 候选药物的安全性和有效性
5.1. mRNA 核苷修饰
mRNA 核苷修饰是一项关键发现,可提高 mRNA 的功效和安全性。卡里科等人。2005 年发现,与未修饰的 mRNA 相比,核苷修饰的 RNA 的免疫原性要低得多 [ 13]]。研究表明,与未修饰的 RNA 相比,掺入修饰的核苷 5-甲基胞嘧啶 (m5C)、6-甲基腺苷 (m6A)、5-甲基尿苷 (m5U)、2-硫尿苷 (s2U) 或假尿苷 (Ψ),显着减少人树突状细胞 (DC) 的细胞因子分泌。增加每个 mRNA 的修饰核苷含量与 DCs 中 TNFα 表达的相对抑制成正比。2008 年,Karikó 等人。进行了小鼠体内研究,发现当 RNA 被修饰时,不仅安全性增加,而且翻译能力和 mRNA 稳定性增加 [ 110 ]。安德里斯等人。在小鼠体内和体外测试翻译和免疫原性,发现掺入 1-甲基假尿苷 (m1Ψ) 的 mRNA 优于掺入 Ψ 的 mRNA [ 111]。由于其显著降低概率输注反应并以增加疗效的能力,今天,m1Ψ已成为各种LNP-mRNA的应用中最常用的RNA修饰:疫苗,治疗性抗体,或RNA蛋白质替代[ 9,78,83 , 112 , 113 ]。例如,BioNTech/Pfizer 疫苗以及针对 COVID-19 的 Moderna 疫苗利用 m1Ψ 修饰的 mRNA [ 9 , 114 ]。
5.2. mRNA序列和结构优化
mRNA 序列和结构优化包括一组已知可改善 LNP-mRNA 疗法的药理学和安全性的策略。优化帽结构、5’和3’UTR、编码序列和poly(A)尾长可能会显着影响LNP-mRNA疗法的性能(图3)。通过 5'-5' 三磷酸桥将 7-甲基鸟苷 (m7G) 帽有效连接到合成 mRNA 并形成 m7GpppN 结构是有效翻译所必需的 [ 115 ]。在细胞质中,eIF4E 翻译起始因子与帽结合,从而开始 mRNA 翻译 [ 116 , 117]。与 poly(A) 尾和 RNA 结合蛋白一起,帽对于 mRNA 环化至关重要,可确保全长翻译和翻译增强 [ 118 ]。此外,在细胞质中,帽与 mRNA 脱帽机制结合,从而影响 mRNA 降解 [ 119 ]。之前讨论过 cap0 而不是 cap1 通过 RIG-I 和 MDA5 诱导细胞因子,并且 IFIT1 可以与 cap0 结合,但对 cap1 或 cap2 的亲和力显着降低 [ 41 , 46 , 47 , 48 ]。因此,预期 cap1 上甲基化的存在也可以提高某些细胞类型的翻译效率 [ 120]。在过去的 20 年中,开发了多种合成帽结构以提高 IVT mRNA 的效率和安全性。可以使用牛痘加帽酶将 Cap 酶促添加到 mRNA 5' 末端,以在牛痘 2' O-甲基转移酶应用后形成 cap0,以完成 cap1,正如最近在 Modernas 的 COVID-19 疫苗 mRNA-1273 [ 114 ] 中使用的那样。或者,可以在 IVT 反应期间在称为共转录加帽的过程中添加帽,如 BioNTech/Pfizer COVID-19 疫苗 BNT162b2 [ 114 , 121 , 122 , 123 , 124]。最近,允许共转录加帽的不同类型的三核苷酸 cap1 类似物在商业上可用。CleanCap CAP1 AG三聚体,和防反转帽类似物(ARCA)CleanCap1被广泛使用[ 120,124,125 ]。
mRNA 的另一个重要结构特征可以定义其稳定性、定位和表达,是位于 mRNA 5' 和 3' 末端的非翻译区 (UTR)(5’UTR 和 3’UTR)[ 126 , 127 ]。它们在其序列中表现出被 microRNA (miRNA)、长 ncRNA (lncRNA) 或 RNA 结合蛋白 (RBP) 识别的顺式调控元件,这些元件会影响翻译并决定 mRNA 的命运。贾恩等人。将 miRNA 靶位点引入治疗性 mRNA 的 UTR 以募集内源性 miRNA,从而降低 mRNA 的脱靶表达 [ 128]]。在他们的研究中,将多拷贝的肝细胞特异性 miR-122 靶位点引入编码凋亡蛋白的 mRNA 的 3’UTR 阻止了健康肝细胞中的 mRNA 表达,同时允许肝细胞癌细胞中的选择性凋亡。利用细胞 lncRNA 和 RBP 对 mRNA 疗法的转录后调控仍处于起步阶段,未来肯定会成为一个有趣的创新领域。在设计最佳 5’UTR 以延长 LNP-mRNA 的表达时,应避免 5’UTR 结构,例如发夹、假结、RNA G-四链体、上游开放阅读框 (uORF) 和整体抑制翻译的上游起始密码子 (uAUG)治疗 [ 127 ]。
用于治疗性 mRNA 的最广泛使用的 5' 和 3’UTR 是来自 α- 和 β-珠蛋白 mRNA 的那些,它们包含增加 mRNA 翻译和稳定性的元素 [ 129 , 130 ]。多项研究为不同的应用筛选了最佳 UTR。例如,阿斯拉尼等人。表明 5’UTR 是蛋白质表达的关键驱动因素,并且在 10 个 5’UTR 的筛选中显示补体因子 3 (C3) 和细胞色素 p4502E1 (CYP2E1) 5’UTR 表现出最大和最一致的蛋白质表达增加相对于人类细胞体外参考 UTR [ 131]。最近建立了一个包含 280,000 个随机 50mer 5’UTR 的库,它们与 polysome 分析和深度学习相结合。随后,他们使用它来构建模型并设计新的 5’UTR,可以指导核糖体加载并提供最佳翻译 [ 132 ]。Orlandini von Niessen 等人最近筛选了 3’UTR 的基序,利用一种无偏的体外方法,其中基序与 mRNA 稳定活性和促进高翻译的活性相关。该筛选发现,使用基于分裂 (AES)-线粒体编码的 12S rRNA (mtRNR1) 的 3’UTR 元件的氨基末端增强子比之前使用的两个头对尾克隆的人类 β-珠蛋白 3’UTR 更有利(2hBg) 在不同系统中,包括用 gp70 编码 mRNA 静脉注射疫苗后的小鼠 [133 ]。这些 3’UTR 元件最近被用于针对 COVID-19 的 BioNTech/Pfizer 疫苗 [ 125 ]。
通过用经常使用的同义密码子替换稀有密码子、增加 G:C 含量和避免某些调节序列来设计最佳编码序列,从而总体上增加 mRNA 蛋白表达(在别处综述 [ 134 , 135 , 136 ])。然而,必须根据治疗性 mRNA 应用和特定目标细胞类型对不同的密码子优化进行经验测试。Poly(A) 尾与帽一起对翻译和 mRNA 稳定性有影响 [ 137 ]。聚 (A) 尾可以在 DNA 质粒模板中定义并在 IVT 反应期间进行转录,以确保聚 (A) 尾长度一致,或者,在 IVT 后,可以使用重组聚 (A) 聚合酶延长 mRNA [ 138]]。两种加尾方法都有局限性:在克隆编码长 poly(A) 尾的质粒过程中存在技术困难,或者在酶促聚腺苷酸化的情况下,在制造过程中确保一致的 poly(A) 尾长度和产品均匀性。今天,大多数治疗性 mRNA 的 poly(A) 尾长度至少为 50nt 到 ≥ 100 nt。根据各种全基因组 poly(A) 尾部分析方法,这些长度类似于大多数内源性 mRNA 的平均长度,这表明大多数 mRNA 尾部明显短于先前认为的 250 个腺苷的尾部长度 [ 139 , 140 , 141 ]。
5.3. IVT mRNA 生产和纯化方法
IVT mRNA 的整个制造过程是一个不断创新和优化的领域,旨在最大限度地减少 dsRNA 和其他污染物的水平,从而降低 mRNA 疗法的免疫原性。
- 例如,吴等人。使用高温和热稳定的 T7 RNA 聚合酶来生产 mRNA,无需纯化即可显示降低的免疫原性 [ 142 ]。
- 然而,广泛使用各种纯化方法以达到单链mRNA的最大纯度。例如,离子对反相高效液相色谱 (HPLC) 仍然被认为是去除目标 mRNA 中不需要的副产物/污染物的金标准方法 [ 143]]。
- 不幸的是,HPLC 难以扩大规模以生产大量 mRNA,并且会导致产生大量危险废物 [ 17 ]。因此,最近开发了纤维素色谱[ 17 ]。该方法在去除 dsRNA 污染物和生产具有高纯度和低免疫激活潜力的 mRNA 方面表现出很高的效率。
5.4. LNP优化
除了优化 mRNA 及其制造,优化 LNP 还具有显着提高基于 LNP-mRNA 的疗法的安全性和有效性的巨大潜力。该领域可能存在差异化的具体主题是
- 针对不同应用途径的可电离脂质和可生物降解脂质的创新;
- LNP-mRNA组成优化;
- 隐形脂质的创新;
- 通过基于 LNP 的变化实现特定的细胞/器官靶向(图3b)。
在本综述中,对这些主题进行了简要总结,而在其他地方对其进行了更深入的综述 [ 4 , 56 ]。 可电离氨基脂质是影响 LNP-mRNA 药物疗效和耐受性的主要 LNP 成分。它们在细胞摄取、内体逃逸和 LNP 将血清蛋白非特异性结合到 LNP 表面的能力方面发挥作用。第一个临床批准的氨基脂质是 MC3(DLin-MC3-DMA)[ 53 ]。然而,已知这种脂质在生物体中具有较长的半衰期,在临床研究中会导致轻度至中度的不良反应,因此对于重复给药应用而言并不理想 [ 144 , 145]]。因此,不断开发新型可电离和完全生物降解的脂质。例如,迈尔等人。使用 MC3 作为开发一组新的可生物降解脂质的基础,其中 L319 显示出从血浆和组织中的快速清除。此外,根据血清化学和组织病理学,在临床前环境中单次推注 L319 时,L319 具有良好的耐受性 [ 144 ]。萨布尼斯等人。使用合理的药物化学方法优化氨基脂质,发现名为 LNP5 的结构在小鼠和食蟹猴中显示出良好的药代动力学、表达谱、内体逃逸效率、组织清除率和耐受性 [ 108]]。虽然这两个描述的研究都集中在静脉内给药 (iv),但 Hasset 等人。专注于肌内应用 (im) 的 LNP 优化并筛选了 30 种新型可电离的可生物降解脂质 [ 62 ]。作者在免疫原性和表达的初步筛选过程中检测到应用途径依赖性差异。将导致 LNP-mRNA 最高表达且免疫原性低的五种新型脂质在小鼠、大鼠和 NHP 中进行肌肉注射 [ 62 ]。
LNP-mRNA 组成的优化包括不同的脂质比率或脂质与 mRNA 的比率。为了优化将 mRNA 递送到肝脏的 LNP,Kaufmann 等人。开发了一种实验设计 (DOE) 方法 [ 146 ]。通过增加可电离脂质:mRNA 的重量比并加入 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE) 作为辅助脂质,与基于 LNP-mRNA 的对照相比,作者显着提高了负载促红细胞生成素 mRNA 的 LNP 的效率关于用于 LNP-siRNA 递送的 LNP 制剂 [ 146 ]。萨戈等人。制定了多个 LNP 库(总共 >250 个 LNP),改变氨基脂质化合物、摩尔量和 PEG 的结构,以及胆固醇的摩尔量 [ 147]。作者为每个 LNP 共同制定了 Cre mRNA 和 DNA 条形码,并将它们静脉注射或肌肉注射到 Lox-Stop-Lox-tdTomato (Ai14) 小鼠。他们基于 Cre mRNA 向 Cre 蛋白的翻译和荧光细胞的分离测试了 LNP 文库在体内的传递,其中目标 DNA 由 Cre 蛋白编辑。这种方法导致鉴定了两种新型 LNP,它们可有效地将 mRNA 递送至内皮细胞 [ 147 ]。该研究表明,优化 LNP 组成不仅对于提高功效而且作为识别具有新趋向性的 LNP 的途径的重要性。
PEG-脂质等隐形脂质对于增加 LNP 颗粒的半衰期和稳定性并影响其理化性质是必要的。在将 LNP-mRNA 注入血液后,LNP 会在其表面吸附大量蛋白质,形成“蛋白质冠”(综述于 [ 63 , 148 ])。其中,这些蛋白质包括白蛋白、免疫球蛋白、脂蛋白、载脂蛋白、凝血因子和补体蛋白 [ 149]]。
- PEG-脂质屏蔽降低了 LNP 与补体和其他蛋白质的相互作用,从而降低了巨噬细胞对 LNP-mRNA 的内化,增加了 LNP-mRNA 在血液中的循环时间。
- 此外,PEG-脂质屏蔽对可能由蛋白质电晕(corona)引起的过滤器官中不希望的聚集和积累有影响[ 148 ]。
- 然而,PEG 屏蔽(shielding)也可能降低对载脂蛋白 E (ApoE) 的识别,并可能导致抗 PEG ADAs 的形成,从而降低 LNP 的效率 [ 60 , 150]。因此,必须优化 PEG 屏蔽水平以获得功效和安全性之间的折衷。
关于抗 PEG ADAs 的形成,Suzuki 等人最近的一项研究。在小鼠中检查了含 PEG 的 LNP-siRNA,发现与长酰基链 LNP 相比,具有快速脱落 PEG 脂质(短酰基链)的 LNP 诱导的抗 PEG IgM 更少 [ 60 ]。与库普弗细胞(肝脏巨噬细胞)相比,快速脱落的 PEG-脂质的使用允许更多的肝细胞靶向,从而提高 LNP-siRNA 药物的有效性 [ 60]]。这项研究与Judge等人先前的研究一致。作者发现,当使用含有较短烷基链 (C14) PEG-脂质与较长烷基链 C16 PEG-脂质的聚乙二醇化脂质体时,抗PEG 抗体形成较少,并且在小鼠重复给药时副作用显着减少[ 151 ] . 直接检查抗 PEG 抗体对含有 PEG 脂质的 LNP-mRNA 药物的疗效和安全性影响的研究仍然非常有限。最近,诺盖拉等人。研究了隐形脂质多聚肌氨酸 (PSar) 的不同链长和摩尔分数,发现与含 PEG 的 LNP 相比,有效的 mRNA 递送具有更低的细胞因子促炎特征、减少的补体激活和肝毒性标志物 [ 59 ]。
定位到特定组织以及将 LNP-mRNA 疗法主动靶向特定细胞类型和器官是一个特别令人感兴趣的话题,它可以改善当前的脱靶效应并为难以靶向组织的新应用铺平道路。正如已经讨论过的,可以通过在 mRNA 水平上进行优化,通过将细胞类型特异性 miRNA 靶位点引入 3’UTR 来实现特定组织的定位,从而导致 mRNA 降解,导致 LNP-mRNA 在选定的细胞类型 [ 128]。然而,LNP 水平的优化是主要关注点,基于改变 LNP 结构成分和优化 LNP 组成的各种方法或使用功能化表面主动靶向特定细胞的方法,例如,使用靶向配体或抗体。大多数目前开发的 LNP 主要通过载脂蛋白 E (ApoE) 介导的摄取定位于肝脏 [ 152]]。ApoE 在循环中与 LNP 结合并促进与肝细胞上的低密度脂蛋白受体 (LDLR) 结合,从而使 LNP-mRNA 内吞到细胞中。因此,目前大多数临床前和临床 RNA 蛋白替代以及罕见疾病研究都考虑了肝脏疾病或通过使用自然积累的较小直径 (<100 nm) 的经典 LNP 制剂将肝脏作为蛋白质生产工厂。在肝细胞中。LNP 颗粒的大小 > 100 nm 可能是肝细胞靶向的限制因素,尤其是在人类中,可以从测量窗孔大小的 Wisse 等人推断 [ 153]]。窗孔是肝脏血窦中的孔,在没有肝脏病理的人类中为 107 ± 1.5 nm,在啮齿动物中的尺寸明显更大:C57BL/6 小鼠(141 ± 5.4 nm)和 Sprague-Dawley 大鼠(161 ± 2.7 nm) [ 153 ]。为了到达肝细胞,LNP-mRNA 必须穿过窗孔(fenestrae),因此将 LNP-mRNA 的大小限制在约 100 nm 以用于肝细胞靶向。
LNP 到其他器官的定位通常需要优化 LNP 或主动靶向。LNP 成分优化在 Sago 等人进行的筛选中的重要性。导致发现有效靶向内皮细胞的 7C2 和 7C3 LNP,如前所述 [ 147 ]。使用与 Sago 等人相同的筛选方法,Gan 等人。最近测试了一个包含 109 个 LNP 的文库,该文库由包含金刚烷基烃链的“受限磷脂”组成 [ 154 ]。这项研究确定了一种新的 LNP,它可以将 mRNA 传递到 Kupffer 细胞而不是肝细胞,而无需靶向配体 [ 154 ]。最近,Zukancic 等人。二手 Onpattro ®LNP,作者用含有短 (C11) PEG 烷基链的吐温 20 替换了 1, 2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-聚(乙二醇)(PEG-DSPE)[ 155 ]。作者发现,使用短 PEG 烷基链可显着改善小鼠肌肉注射后的淋巴结靶向 [ 155 ]。很少有研究专注于主动靶向淋巴细胞。拉米什蒂等人。通过抗 CD4 单克隆抗体功能化 LNP 表面以靶向 CD4+ T 细胞 [ 156 ]。维加等人。已经使用了一种资产(锚定二级 scFv 启用靶向),其中抗 Ly6c mAb 与 LNP 相连,以靶向 Ly6c+ 炎症性白细胞 [ 157]。作者在炎症性肠病的葡聚糖硫酸钠 (DSS) 结肠炎小鼠模型中应用抗 Ly6c mAb 包被或同种型对照 LNP 配制的 IL-10 mRNA 测试了这一策略,他们显示了靶向 LNP-mRNA 与. 非针对性方法。最近,Ramishetti 等人。合成了一组新的可电离脂质,将它们用于 mRNA 制剂,筛选白细胞中 LNP-mRNA 的表达和安全性,并使用 β7 整合素主动靶向原代淋巴细胞 [ 158 ]。为了积极针对发炎的脑组织,Marcos-Contreras 等人。标记的抗血管细胞粘附分子 1 (VCAM) mAb 到 LNP 配制的血栓调节蛋白 mRNA [ 159]。VCAM 在脑血管内皮和 VCAM 靶向的 LNP-血栓调节蛋白 mRNA 中高表达,这些 mRNA 在 TNFα 损伤的脑小鼠模型中积累,并减少了由 TNFα 注射引起的脑水肿 [ 159 ]。类似地,抗血管细胞粘附分子 PECAM-1 mAb 用于靶向肺的 LNP-mRNA,与非靶向组织相比,其递送增强了约 200 倍 [ 160 ]。
如果在优化 mRNA 和 LNP 后,LNP-mRNA 不良免疫刺激特征的成分持续存在,抑制和降低潜在不良反应的另一种可能性是将强效皮质类固醇直接加入 LNP-mRNA 药物产品中(图3c) . 陈等人。将地塞米松(一种有效的皮质类固醇)掺入含有各种类型核酸的 LNP [ 161]。他们使用可生物降解的接头将亲脂性酰基/烷基部分化学偶联到地塞米松,并合成了可有效掺入 LNP 的地塞米松前药。使用含有 10 mol% 地塞米松的 LNP-mRNA 可显着改善免疫刺激,导致 IL-6、TNFα、IL12p70、IL-1β、IL-10 和角质形成细胞化学引诱物 (KC)/人类生长调节致癌基因的显着减少( GRO) (KC/GRO) 在小鼠体内以 3 mg/kg 的 mRNA 剂量 iv 注射后 4 小时的血浆中。有趣的是,与与 LNP-mRNA 治疗剂共同给药的游离地塞米松相比,掺入的地塞米松的免疫抑制作用显着更高 [ 161]]。其他防止 LNP-mRNA 潜在有害免疫刺激的策略是使用其他小分子或 siRNA 来对抗关键的先天免疫反应介质(最近 [ 2 , 162 ]对此进行了评论)。然而,这种先天免疫抑制剂的有效性仅在极少数特定情况下建立,表明更广泛适用性的潜在挑战和进一步研究的必要性。
六、结论
在过去的几年里,我们见证了基于 RNA 的技术及其应用的加速增长。第一个用于治疗转甲状腺素蛋白介导的淀粉样变性的 LNP-siRNA 药物 Onpattro®于 2018 年获得批准。 最近,两种针对 SARS-CoV-2 病毒的 LNP-mRNA 疫苗获得了全球多个监管机构的紧急或有条件的上市许可。然而,虽然其他预防性疫苗的临床研究仍然很少(例如巨细胞病毒 (CMV)、寨卡病毒和狂犬病),但积极招募临床研究的众多癌症疫苗和免疫肿瘤学处于 1 期或 2 期。 BioNTech、Moderna、CureVac等LNP-mRNA技术开发领域专注于以下适应症的癌症免疫治疗应用:黑色素瘤、非小细胞肺癌(NSCLC)、头颈癌、三阴性乳腺癌、前列腺癌、胰腺癌和卵巢癌以及多种实体瘤。不同的 mRNA 治疗领域在 LNP 和 mRNA 开发和制造方面存在显着相似之处。
- 相似之处包括 mRNA 序列和结构的所有基本共性,应该类似于内源性 mRNA 和 LNP 的特征,应该允许最有效地转移到感兴趣的细胞。
然而,免疫疗法(疫苗和癌症免疫疗法)和非免疫疗法(RNA 蛋白替代和一些单克隆抗体疗法)应用之间也存在一些差异。
- 在大多数免疫治疗应用(传染病和癌症疫苗)中,基于合成 mRNA 和 LNP 成分的自然识别模拟病毒攻击的免疫系统增强可能是有益的 [ 1 , 163 ]。例如,发现单链抗原编码 RNA 寡核苷酸可诱导 T 辅助细胞 1 (Th1) 型细胞因子,并同时激活先天免疫反应和适应性免疫抗原特异性反应 [ 15]]。
- 相反,在非免疫治疗应用中,微调 LNP-mRNA 成分以完全减少免疫激活并提高安全性至关重要。
因此,了解 LNP-mRNA 非免疫治疗候选药物的基本药效学和药代动力学及其与宿主免疫系统的相互作用是必要的。因此,许多临床前研究进行了长时间的优化,以确保在进入临床前高度关注安全性。多年来,免疫疗法和非免疫疗法 mRNA 治疗领域都经历了大量创新和显着增长。自扩增 mRNA (saRNA) 编码复制酶和感兴趣的蛋白质,并利用病毒复制策略在细胞中复制(在别处进行了全面审查 [ 164 , 165])。
saRNA 在细胞扩增过程中产生 dsRNA 中间体,是免疫系统的有效激活剂,是免疫治疗的创新工具之一。传统 mRNA 和 LNP 结构域中的 mRNA 修饰和其他许多改进,以及它们的制造,一直并且正在继续进行。然而,由于这是一个相对年轻的领域,因此有必要努力更好地阐明不仅收集传统毒理学和组织病理学数据的必要性,还需要收集诸如细胞因子/趋化因子、补体和抗药物抗体等扩展安全性数据。发现这些标志物更敏感,可以作为潜在不良反应的更好预测指标。为了更好地预测临床结果,类似于它们在小分子药物领域的使用,系统生物学和建模也应该在 LNP-mRNA 的临床前研究中得到越来越多的利用。此外,需要致力于更好地理解非临床研究模型的预测价值以及模型系统之间的差异。此外,开发原代人类细胞、组织和器官培养物作为测量 LNP-mRNA 治疗效率和安全性的模型将是有益的。 综上所述,目前只有少数 1 期临床研究在 RNA 蛋白替代/罕见病领域进行。进一步努力优化 LNP-mRNA,研究与小分子药物或其他医学治疗联合的潜力,以及改进临床前和监管指南,肯定会导致更多高质量的临床前和临床 LNP-mRNA 非免疫疗法研究。特别是,预计中和单克隆抗体的交付(例如目前正在进行的针对基孔肯雅病毒的 mRNA-1944 临床研究,NCT03829384)和在许多适应症中存在大量未满足医疗需求的罕见疾病领域将产生巨大影响。
参考资料
- 2021,settings Open AccessReview Non-Immunotherapy Application of LNP-mRNA: Maximizing Efficacy and Safety。 https://www.mdpi.com/2227-9059/9/5/530/htm
