【9.8.2.2】RNA的U修饰(假尿嘧啶)
治疗性 mRNA 至少还有两个额外的大挑战:
- 体外转录 (IVT) mRNA 在注射到动物体内时容易发生核酸酶降解
- IVT mRNA 也会导致先天性免疫原性类似于被病原体感染时会发生的情况(Martinon 等人,1993 年; Hoerr等人,2000 年)。
这些问题的答案来自一种众所周知的 RNA 修饰,即假尿苷 (Ψ),它可用于替换 IVT mRNA 中的尿苷。证明 Ψ 可以增强 RNA 稳定性,同时降低抗 RNA 免疫反应 ( Karikó et al., 2008)。这种 Ψ 效应可能至少部分与以下事实有关,即 Ψ 是一种具有独特化学性质的天然修饰核苷酸,并且 Ψ 在几乎所有细胞的所有 RNA 中都非常丰富和自然广泛存在
一、Ψ 是在多种 RNA 中发现的丰富的天然修饰核苷酸
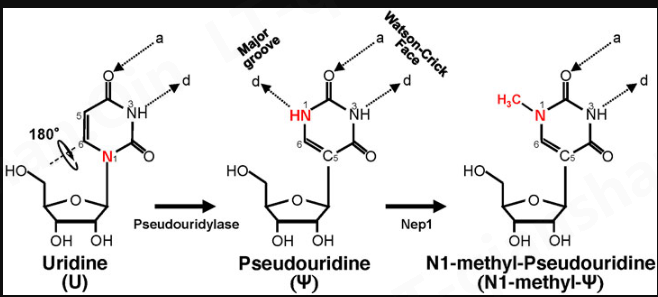
Ψ 是 7 年前发现的第一个修饰的核糖核苷酸(Cohn 和 Volkin,1951;Davis 和 Allen,1957),它已在 tRNA、rRNA、snRNA、mRNA 和其他类型的 RNA 中发现(Carlile 等,2014;Lovejoy 等人,2014 年;Schwartz 等人,2014 年)。Ψ 是通过称为假尿苷化的碱基特异性异构化反应衍生自尿苷(图 1),其中核碱基围绕 N3-C6 轴旋转 180°,导致核碱基-糖键(从 N1-C1' 键变为C5-C1’键)。由此产生的 CC 键允许核碱基更自由地旋转 ( Adachi et al., 2021)。
此外,Ψ 可以在大沟中提供额外的氢键供体(在 N1H 中),同时在 Watson-Crick 面中保留氢键供体和受体(与其原始尿苷相同)。虽然这些变化看起来很微妙(事实上,Ψ 可以像尿苷一样与腺苷进行碱基配对),但 Ψ 可以以相对显着的方式改变 RNA 结构,主要是通过改善碱基配对、碱基堆叠和有助于使主链更多刚性(通过氢键相互作用网络)(Davis,1995;Charette 和 Gray,2000;Newby 和 Greenbaum,2001,2002a,2002b)。因此,RNA 假尿苷化通常使 RNA 稳定。因此,这种 RNA 修饰的存在赋予 RNA 不同的生物物理和生化特性也就不足为奇了。例如,Ψ 有利于 RNA 中的 C3'-endo 构象(Kierzek 等人,2014 年;Westhof,2019 年)。此外,Ψ 似乎增加了 RNA 对核酸酶的保护。Naylor 等人的一项研究。表明与含 U 的对应物相比,含 Ψ 的二核苷酸更能抵抗蛇毒和脾脏磷酸二酯酶的降解(Naylor 等人,1965 年)。
二、Ψ 可以欺骗免疫系统
进入细胞后,未修饰的 IVT mRNA 具有内在的免疫原性(Weissman 等人,2000)。多年来,这一挑战减缓了 mRNA 疗法的发展,尤其是 mRNA 替代策略的发展。例如,已经表明,当用未修饰的 IVT mRNA 处理时,树突状细胞会促进 T 细胞反应(Weissman 等人,2000)。Toll 样受体 (TLR) 的激活,特别是 TLR3(TLR 家族的成员),可以识别双链病毒 RNA,是这种免疫反应诱导背后的机制之一 ( Karikó et al., 2004)。在另一项工作中,有人提出单链 RNA 也可以在细胞中诱导免疫反应。在那项工作中的作者表明,HIV 衍生的富含尿苷的单链 RNA 可以通过 TLR7 和 TLR8 的识别刺激树突状细胞产生细胞因子 ( Heil, 2004 )。后来,进一步提出 TLR7 可以识别 RNA 中紧邻的尿嘧啶重复序列 ( Diebold et al., 2006 )。为了解决这个问题,Karikó 等人。想出了一个绝妙的解决方案。他们发现,将 Ψ 作为尿苷的替代物加入 IVT mRNA 可以抑制这种免疫反应机制 ( Karikó et al., 2005)。这一发现揭示了 Ψ 的另一个关键方面,并首次暗示 RNA 修饰可能是建立 mRNA 作为一种新的治疗方式所必需的。然而,在这一发现时,一些人认为未修饰的 mRNA 免疫治疗将是比修饰的 mRNA 更好的方法,因为 RNA 本身将充当佐剂(Ishii 和 Akira,2005 年)。
三、Ψ 对蛋白质翻译有影响
由于 Ψ 对 RNA 结构、稳定性和一般化学性质的影响,因此这种 RNA 修饰也会影响真核生物中 mRNA 向蛋白质的翻译也就不足为奇了。例如,一项早期工作揭示了 Ψ 在线粒体 tRNA 反密码子中提供的异常解码事件。如果反密码子没有被假尿酸化,假尿酸化的反密码子可以有效地读取替代密码子,否则这些密码子在线粒体中的翻译过程中将很难识别(Tomita,1999)。另一项研究表明,先前观察到的 Ψ 修饰的 mRNA 的可翻译性增加(Karikó 等人,2008 年)是由于未修饰的 mRNA 更容易激活,通过结合,一种 RNA 依赖性蛋白激酶 (PKR),而不是 Ψ 修饰的 mRNA。该 PKR 负责翻译起始因子 2-α (eIF-2α) 的磷酸化,并最终降低翻译效率 ( Anderson et al., 2010 )。
Ψ 也影响终止密码子解码。Yu 实验室表明,产生提前终止密码子 (PTC) 的无义突变可以通过人工框 H/ACA 指导 RNA ( Karijolich 和于,2011 年;Morais 等人,2020 年)。通过免疫沉淀和质谱法在酵母中确定掺入假尿酰化 PTC 的氨基酸的身份:主要是 ΨGA 密码子的苯丙氨酸/酪氨酸和 ΨAA 和 ΨAG 密码子的苏氨酸/丝氨酸。后来发现,这种新的重新编码机制可能是由于核糖体解码中心不寻常的密码子-反密码子碱基配对方案而发生的(Fernández et al., 2013)。
最近,据报道 Ψ 还能够调节可翻译性或有义密码子解码 ( Eyler et al., 2019 )。作者使用大肠杆菌翻译系统或人类细胞(人类胚胎肾细胞)证明,Ψ 可以在很小程度上改变核糖体或密码子与同源和近同源 tRNA 的相互作用,从而导致氨基酸取代。有人提出,这种氨基酸取代机制可能是在应激条件下适应的宝贵来源,例如氧化和温度应激。
四、N1-甲基化 Ψ 表现优于 Ψ
由于发现 Ψ-修饰可以使 mRNA 抵抗内在免疫反应 ( Karikó et al., 2005 ),因此对可能具有改进特性的 Ψ-衍生物进行了搜索。N1 位的胺基 (NH) 提供了额外的氢键供体(在假尿苷化后产生)(图 1),引起了特别的关注。一种 N1 修饰的 Ψ-衍生物是 N1-甲基-Ψ,这是一种在 18S rRNA ( Brand et al., 1978 ) 和许多生物体中的 tRNA ( Boccaletto et al., 2018 ) 中发现的天然修饰。这种 N1 甲基化由在古细菌和真核生物中发现的 N1 特异性 Ψ 甲基转移酶 Nep1 催化(Wurm 等人,2010 年)(图 1)。鉴于目前的标准 Ψ 检测 (-seq) 方法依赖于使用 CMC 修饰和引物延伸(Morais 等人,2021 ),可能无法区分 N1-甲基-Ψ 和 Ψ ( Svitkin et al., 2017 )。因此,可能到目前为止,一些 Ψs ( Schwartz et al., 2014 ) 实际上可能是 N1 甲基化的 Ψs。

参考资料
- The Critical Contribution of Pseudouridine to mRNA COVID-19 Vaccines。 https://www.frontiersin.org/articles/10.3389/fcell.2021.789427/full
