【6.2】CureVac 疫苗
主要采用RNActive®
同样值得注意的是,CureVac 疫苗的设计目的是在常规冰箱温度下保持稳定,甚至在室温下保持一天。
一、非化学修饰
mRNA 疫苗试图让 mRNA 进入我们的细胞,以说服它们制造大量的 SARS-CoV-2 S 蛋白。
效果如何显然至少取决于:
- 我们进入细胞正确部分的 mRNA 有多少
- 核糖体(“蛋白质打印机”)对 mRNA 的吸收程度
- mRNA能存活多久
- 我们的免疫系统付出了多少关注
来自 BioNTech 和 Moderna 的化学修饰核苷可能是第一部分的王牌—— “Toll 样受体”不关注修饰的 RNA。这可能使 mRNA 更容易在“细胞质”中存活,这是细胞中发生魔法的部分。请注意,人们对 LNP 如何将 mRNA 引入细胞的许多过程知之甚少。
然而,CureVac 似乎可以通过其他三个方面来补偿其未修饰的 mRNA - 巧妙制定的 mRNA 序列可能更容易翻译成蛋白质形式,并且它也可能在更长时间内保持稳定(有活性)。
二、CureVac 疫苗中有什么?
5‘UTR
一开始,事情非常标准(如我之前的帖子)。有一个帽,后跟5'-UTR(非翻译区)。如前所述,UTR 会影响 mRNA 翻译成蛋白质的频率、效果和时间。

有趣的是,CureVac 5'-UTR在大型 DNA 数据库中没有命中。在所有。相比之下,BioNTech 5'-UTR 很容易找到(源自“智人血红蛋白亚基 α2 (HBA2)”),但 CureVac 是匿名的。描述 CureVac 疫苗的WHO INN 文件也承认并称该序列为“人工核苷酸”。
药物开发人员在分子生物学中所做的很多事情更像是施展咒语而不是工程。其他疫苗似乎从自然界中挑选了一种已知效果良好的 5'-UTR。这样的序列通常有数百个核苷酸长。相反,CureVac 插入了一个非常简短的序列,该序列似乎包含使事情工作的最低限度。
GGAGA AAGCUU ACC
从末尾开始,“ACC”是Kozak 序列(Kozak sequence)的一个近乎强制的部分,该序列告诉核糖体接下来是起始密码子,并且蛋白质编码区即将开始。
AAGCUU之前在 CureVac 文档中提到它是一个 侧翼克隆站点(flanking cloning site.)。这很可能是“亚克隆技术”的产物。所以它可能不在那里,因为它在生物学上有帮助,而是因为它必须在那里,使细菌HindIII 限制性内切酶 能够在 mRNA 疫苗的生产过程中在正确的位置切割 DNA。
这给我们留下了 5'-UTR 的开始,GGAGA. mRNA 疫苗的生产过程从 DNA 开始,然后需要将其转化为 RNA。这种转化是由我们从 T7 噬菌体(一种细菌病毒)借来的蛋白质进行的。
T7聚合酶在开始为我们进行高贵的转化工作之前需要一个前导序列,这个序列是 TAATACGACTCACTATAG|GGAGA,其中第一部分是前导,第二部分是第一个真正转录成RNA的DNA。瞧,GGAGA这就是我们在疫苗开始时看到的。
总而言之,CureVac 5'-UTR 非常小,似乎主要包含来自限制酶和复制酶的“技术”伪影,以及强制性的 Kozak 序列。
关于“限制酶”的小贴士
在 CureVac 疫苗的各个地方,我们找到了使用限制酶的证据 。这些东西很吸引人,我们从细菌领域借用它们来为我们切割 DNA。
限制酶识别特定的 DNA 序列,然后将其切割。其中一些酶在匹配序列附近或内部的一个非常特定的位置切割,这使得这些酶对基因操作活动非常有用。
细菌运动了很多这些限制酶。事实证明,我们并不是唯一感染病毒的人,细菌也有这个问题。细菌已经存在了 40 亿年,而且它们似乎在很长一段时间内一直在与病毒作斗争。
每当细菌病毒(也称为噬菌体)将其 DNA 注入细菌时,限制性内切酶就会随时准备将这些 DNA 切割成碎片。通过在许多短 DNA 序列上“匹配”,它们几乎总能匹配病毒基因组中的某处,然后在那里造成损害。
这当然很好,但是细菌如何防止它们的限制酶切割它们自己的 DNA 呢?事实证明,他们有第二组酶在会被限制性酶攻击的区域“涂漆”(paint),从而保护它们。刚到达的噬菌体染色体还没有这样的油漆(“甲基化”)来保护它。
当然,关键是不要在限制性内切酶切割之前先绘制细菌病毒染色体,这有时会失败。奇怪的是,一旦这样的噬菌体被涂成这样并在细菌中定居,当它繁殖时,它的后代也会得到保护漆(paint),并能够感染更多(相同的)细菌!
许多限制性内切酶的精确度不合理,人们强烈 怀疑正在发生的事情比表面上看到的要多。但无论出于何种原因,限制性内切酶都是分子生物学领域值得信赖的交易工具。
回到疫苗,在那里我们遇到了 S 蛋白本身
有64个密码子(444),但只有20个氨基酸。因此,许多氨基酸有 4 种甚至 6 种在 RNA 中“书写”它们的方式。这为改变 RNA 序列留下了很大的空间,而不会改变实际的蛋白质。
所有疫苗都以一种宏伟的方式这样做,至少因为众所周知,在其中填充尽可能多的 C 和 G 核苷酸是增强 mRNA 稳定性和改善蛋白质表达的一种方式。
原始 SARS-CoV-2 RNA 的 GC 含量为 37%。CureVac 将这一比例提高到 63%,而 BioNTech 则为 56%。
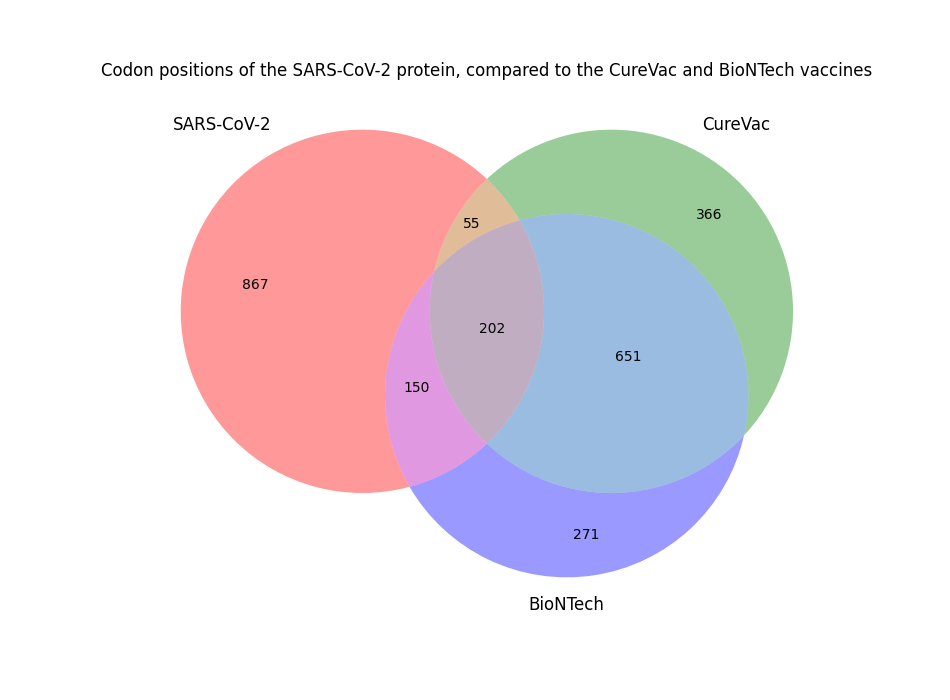
两种疫苗和原始 SARS-CoV-2 S 蛋白中都有 1274 个密码子位置。在这个维恩图中,我们可以看到其中 202 个在疫苗和原始病毒中是相同的。
我们还可以看到,CureVac 有 366 处独特的变化,而 BioNTech 有 271 处独特的修改。最后,两种疫苗共有 651 处修饰。
总的来说,CureVac 版本的修改幅度更大。
3'-UTR
不仅在实际蛋白质描述之前有一个未翻译区域,在末尾也有一个,这就是所谓的 3'-UTR。
CureVac 3'-UTR 被描述为'3839-3912:非翻译区(3' UTR),包含以下元件:人α-珠蛋白3' UTR 序列元件(3861-3904)'。
这意味着 3'-UTR 长 74 个核苷酸,其中中间的 44 个核苷酸来自一段人类 DNA。
前 23 个核苷酸 GGACU AGUUA UAAGA CUGAC UAG的来源不明,但如果我们使用古老的“BLASTn”搜索,我们会在其他生物体中发现的 mRNA 序列中发现许多部分命中,主要是在 Odontomachus brunneus 蚂蚁物种中。然而,这很可能是巧合。如上所述ACU AGU,其中的部分来自 SpeI/AhII/BcuI 限制性内切酶。
BLASTn 将中间的“人类”DNA 识别为来自智人 α-2 珠蛋白 (HBA2) 基因的 3'-UTR。
同时,最后一个核苷酸GAGAU UAAU显示没有命中 BLASTn,我不知道这可能是什么。
poly(A)
人类 mRNA 通常以 AAAAA 序列结束。该序列保护 mRNA 免于降解。随着时间的推移,尾随的 A 会丢失,一旦 Poly(A) 尾消失,mRNA 就会迅速消除。
我们拥有序列的两种疫苗中都存在此特征。
poly(C)
现在这就是它变得有趣的地方。如前所述,mRNA 疫苗效率的游戏名称是让细胞产生足够的 SARS-CoV-2 蛋白。要做到这一点,必须有足够的 mRNA 进入细胞质,而且它也应该被核糖体足够频繁地摄取。然后它必须停留足够长的时间。
鉴于未修饰的核苷可能不太可能逃避我们的免疫系统,CureVac 疫苗必须在其他地方进行补偿。
在这里,我们遇到了 CureVac 做了一些不同的事情的第一个区域,Poly(C) 拉伸(也就是一堆 C)。
对 RNA 中富含 C 的基序的研究仍然相当新鲜,但有迹象表明 ,当 αCP(或聚(C)结合蛋白(PCBP))与这样的区域结合时,[它可以增强 mRNA 的稳定性](s聚(C)结合蛋白(PCBP)),以及它的进一步表达。
组蛋白茎环
人类染色体是巨大的。虽然细菌染色体可能由几百万个碱基对组成,但人类基因组的时钟超过 30 亿个。由于染色体是一式两份,这意味着一个细胞核拥有超过 60 亿个核苷酸。
人类细胞核的直径约为 10 微米,总共包含约 2 米的 DNA。将两米(6 英尺)的 DNA 放入这么小的体积需要一些工作。如果您曾经尝试将电缆存放在盒子中,您就会知道它的效果如何。
人类(以及动物和植物)DNA 在“组蛋白”的帮助下储存。复杂性是巨大的,但总结的总结是组蛋白结合在一起形成纺锤体,DNA 围绕纺锤体形成环。这种存储结合了稳定性和(选择性)可用性。

复制人类细胞需要很多时间,特别是“ S 期”,在这个阶段,新 DNA 的产生和储存会持续数小时。
至关重要的是,在这个 S 阶段,DNA 正忙于复制,而在此期间并没有产生大量新的 RNA。然而,在复制过程中,需要大量组蛋白的稳定供应,因此可以正确存储新的 DNA。
换句话说,我们需要的是高度稳定的 mRNA 序列,这些序列将持续产生组蛋白数小时。
这听起来就像我们的疫苗所需要的一样!
产生组蛋白的 mRNA 序列没有 poly(A) 尾,但它们在末端有一个“组蛋白茎环序列”。这可能确保它们的寿命。
在一个被证明是成功的实验中,CureVac 发现您可以将 poly(A) 尾和组蛋白茎环添加到 mRNA,并且这些机制对 mRNA 稳定性具有累加效应。
“本发明基于本发明人的惊人发现,即聚 (A) 序列或聚腺苷酸化信号与至少一个组蛋白茎环的组合,尽管两者都代表自然界中的替代机制,但协同作用如下组合增加了蛋白质表达的多样性,高于使用任一单个元素观察到的水平。无论poly(A) 和组蛋白茎环的顺序如何,也无论poly(A) 序列的长度如何,都可以看到poly(A) 和至少一个组蛋白茎环组合的协同效应。” - 来自CureVac 专利。
三、总结
CureVac mRNA 未经过化学修饰。这可能意味着它更难到达细胞的正确部分,因为免疫系统不喜欢外来 mRNA。
在 CureVac mRNA 序列中,我们发现了各种可能增加疫苗 mRNA 活性和寿命的机制。相对而言,CureVac 序列比在其他疫苗中发现的序列进行了更多的修改,它包含两个额外的序列,可能会产生很大的不同:poly(C) 序列和组蛋白茎环。
此外,mRNA 的未修饰性质也可能是一种祝福:通过提醒我们的免疫系统,可能会引发更强烈的反应。
很快我们将了解到 2/3 期“HERALD”试验的结果,这有望告诉我们非化学修饰的 CVnCoV mRNA 疫苗是否对 SARS-CoV-2 有效。
6 月 16 日更新:结果出来了,但令人失望。
参考资料
