【4.2】mRNA癌症疫苗
mRNA癌症疫苗是一类相对较新的疫苗,它结合了mRNA的潜力,可以编码几乎所有蛋白质,具有出色的安全性和灵活的生产工艺。
- mRNA疫苗在肿瘤学领域中最直接的用途是使用编码肿瘤相关抗原(TAA)的mRNA疫苗对患者进行免疫。这是由RNActive例证®该技术可在动物模型中诱导平衡的体液和细胞免疫反应,目前已在多项临床试验中评估了肿瘤学适应症。
- mRNA疫苗的第二个应用是生产个性化疫苗。这是可能的,因为mRNA疫苗是通过通用方法生产的,可用于快速生产靶向针对患者特异性新抗原的mRNA疫苗,这些抗原是通过分析肿瘤外显子组来鉴定的。
除了直接用于给患者接种疫苗外,mRNA还可以用于细胞疗法中,以在体外转染患者来源的细胞,并将经过处理的细胞重新注入患者体内。
- 一种这样的应用是用编码TAA的mRNA转染患者来源的树突状细胞(DC),这导致TAA衍生肽在DC上的呈递以及体内抗原特异性T细胞的激活。
- 第二个应用是用编码嵌合抗原受体的mRNA转染患者来源的T细胞,这使T细胞可以直接识别在肿瘤上表达的特定抗原。
在本章中,我们将回顾不同方法的临床前和临床数据。
一、mRNA癌症疫苗
1.1 引言
mRNA疫苗的概念是建立在观察到信使RNA(mRNA)导致局部蛋白表达(Wolff et al。 1990年)和针对编码抗原的免疫反应(Martinon et al。 1993年)的基础之上的。鉴于体液和皮肤中RNase的大量存在,这导致RNA的快速降解,例如在含血清的培养基中(Rammensee,Rammensee),这非常出乎意料2006年),基于核酸的疫苗开发的大多数工作仍集中在DNA疫苗上,而不是RNA疫苗上。随着一些技术平台的出现,这种观点也发生了变化,这些技术平台已经证明了mRNA疫苗表达抗原以及诱导体液和细胞免疫应答的潜力。
尽管两个基于核酸的平台都具有许多特征,但与基于DNA的平台相比,mRNA疫苗具有多个优势(表 1)。
- 首先,RNA只需要通过质膜即可诱导蛋白质合成,与需要额外穿过核膜的DNA相比,它可以促进疫苗的递送。
- 其次,mRNA无法整合到基因组中,因此没有致癌潜力。最后,mRNA编码蛋白的表达本质上是瞬时的,由mRNA的短半衰期定义。
因此,与DNA相比,mRNA疫苗具有显着提高的安全性。
-
DNA RNA Delivery DNA needs to cross both cell and nuclear membranes and be first transcribed in the nucleus before protein expression occurs RNA only needs to gain entry into the cytoplasm, where translation and thus protein expression directly occur Integration DNA vaccines are able to integrate into the host genome, which might result in insertional mutagenesis and chromosomal instability RNA cannot integrate into the genome and therefore has no oncogenic potential Expression Long-term expression possible (months to years), depending on vector Transient expression
此外,与更广泛使用的基于蛋白质的疫苗平台相比,mRNA疫苗具有重要的优势:
- 注射mRNA后,被接种者细胞内源性产生蛋白质可支持正确的蛋白质修饰(例如糖基化模式),并消除了对精细蛋白质的需求或颗粒纯化步骤。
- 从技术角度来看,与基于蛋白质的疫苗不同,mRNA可以在完全合成的生产过程中生产,并允许使用相同的生物化合物和生产步骤来生产编码任何蛋白质或所选蛋白质组合的mRNA,从而极大地促进了疫苗的生产流程。
- 此外,支持快速序列调整的能力使RNA疫苗具有高度的通用性,这在大流行环境或个体化治疗中尤为重要
1.2 RNActive ®疫苗
第一部分侧重于RNActive ®技术(CureVac AG),作为目前在肿瘤学适应症几个临床试验中进行评估的mRNA疫苗平台的例子。
RNActive ®疫苗由配制的mRNA的其中可供选择的抗原蛋白质编码和功能的修改,以提高翻译效率,延迟mRNA的降解,提高免疫刺激。
2000年,Hoerr等人。他描述了编码模型抗原β-半乳糖苷酶的mRNA在体内的应用导致特异性细胞毒性T淋巴细胞(CTL)和抗体的诱导(Hoerr等,2003,2000)。这些实验所用的RNA具有mRNA的基本设计,由一个帽,一个编码β-半乳糖苷酶的开放阅读框(ORF)组成,该框架位于5’和3’旁,旁边是β-珠蛋白的非翻译区(UTR),和一条poly(A)的尾巴。对于当前RNActive ®技术上,mRNA的几个方面已被修饰以增加抗原表达的程度和持续时间。β-珠蛋白UTR已被为提高翻译效率和mRNA稳定性而选择的UTR所取代,并且ORF已通过根据专有算法富集鸟嘌呤和胞嘧啶(GC)含量而优化以增强蛋白质表达。这些变化以及使用定义长度的模板编码的poly(A)尾巴,优化的缓冲液和纯化导致在各种测试系统(Kallen和Theß)中蛋白质表达增加了4到5个数量级。2014年)。重要的是,该技术仅采用未修饰的核苷酸。Karikó的研究(Karikó等。2008年)和安德森(安德森等。 2010年)已证明修饰的核苷酸可导致蛋白质表达增加。然而,它们也降低了免疫原性,使得在疫苗的情况下不利于使用修饰的核苷酸。
除了可获得抗原外,佐剂对于诱导强烈的免疫反应也是必不可少的。在RNActive ®疫苗,免疫刺激能力经由合适的制剂,例如来实现,通过使用鱼精蛋白,阳离子肽,其与核酸形成稳定的复合物。鱼精蛋白与mRNA结合并导致形成更大的颗粒,从而在涉及内体驻留型TLR7(Toll样受体7)的过程中激活免疫系统(Fotin-Mleczek等人。2011年; Kallen等。2013年; Scheel等。2005年; Kowalczyk等。2016年)
因此,RNActive ®疫苗包含起到互补功能的两个组成部分:
- “裸”的mRNA,其作为负责将编码抗原的强表达一个翻译模板
- mRNA -鱼精蛋白复合物,其增强疫苗的免疫刺激能力。
事实上,接种RNActive ®疫苗已经显示出强大的诱导和平衡的免疫反应,即Th1和Th2,体液免疫和细胞和效应和记忆反应。在癌症免疫治疗领域和预防性疫苗,各种动物模型系统(包括小鼠,雪貂和猪)均获得了令人鼓舞的结果(Fotin-Mleczek等人。2011年, 2012年)。
1.2.1 诱导抗肿瘤反应与RNActive的®疫苗
RNActive的抗肿瘤功效®疫苗最初研究了E.G7-OVA肿瘤模型。该系统使用C57BL / 6小鼠,将其同种E.G7-OVA细胞系皮下接种,该E.G7-OVA细胞系是已被稳定转染以表达卵清蛋白的小鼠胸腺瘤EL4细胞系的克隆(Moore等。1988年)。该疫苗首先在预防环境中进行研究。用编码卵清蛋白的mRNA疫苗皮内免疫小鼠两次,并在一周后用E.G7-OVA细胞攻击。相较于已收到的mRNA疫苗编码无关抗原的对照小鼠中,OVA-RNActive ®处理组显示在肿瘤生长(Fotin-Mleczek等一个显著延迟。2011年)。另外,接种疫苗的OVA-RNActive ®在比较接种卵清蛋白蛋白或OVA肽SIINFEKL(Fotin-Mleczek等人诱导优越肿瘤保护。2012年)。
详尽的分析表明,抗原特异性疫苗接种已诱导了均衡的体液和细胞免疫反应,其中滴度高的卵清蛋白特异性IgG1和IgG2a抗体以及细胞毒性T细胞在体外被OVA衍生肽刺激后会分泌IFN-γ。并杀死体内装有OVA肽的细胞。使用抗原PSMA的进一步实验表明,细胞毒性反应是可增强的,并导致T记忆细胞的形成。与PSMA-RNActive增加每两周接种的数目®疫苗从2到感应在数量IFN-γ分泌CD8的显著增加4个或6接种+急性期的T细胞和体内细胞毒性。在最后一次免疫后8周,在记忆期分析这些小鼠时,通过增加疫苗接种数量,观察到分泌IFN-γ的CD8 + T细胞数量和体内细胞毒性的相似增加。重要的是,这些IFN-γ分泌的CD8 + T细胞显示的记忆T细胞标记物CD44和主要表现出效应记忆表型(CD44 +,CCR7 -,CD62L - )。此外,与对照组相比,反复接种疫苗不会在小鼠中诱导检测到调节性T细胞的频率(Fotin-Mleczek等。2011年)。
为了测试该技术在治疗环境中的功效,再次使用了E.G7-OVA模型。小鼠用肿瘤细胞皮下攻击并获得了OVA-RNActive ®疫苗,每周两次,一旦肿瘤之情溢于言表。该治疗导致肿瘤生长显着延迟,但不能根除肿瘤。随后的定量RT-PCR分析显示,用卵清蛋白编码的mRNA疫苗治疗的所有小鼠的长大的肿瘤中卵清蛋白的表达均降低或什至不存在,而只有未治疗小鼠的1/5出现这种情况。这表明,在RNActive肿瘤®疫苗治疗的小鼠逃脱免疫治疗由于卵清蛋白(Fotin-Mleczek等人的下调。2011年)。
疫苗接种后几个时间点的肿瘤细胞组成分析表明,经免疫接种的小鼠体内活化的CD8 + T细胞向肿瘤的流入不断增加。在效应期期间,CD8 + T细胞的耗竭,而不是CD4 + T细胞的耗竭,完全消除了疫苗的抗肿瘤作用。相反,在免疫反应的启动阶段需要CD4 + T细胞,因为它们在疫苗接种期间的消耗会大大降低疫苗效力(Fotin-Mleczek等。2011年)。
1.2.2临床研究与RNActive ®疫苗
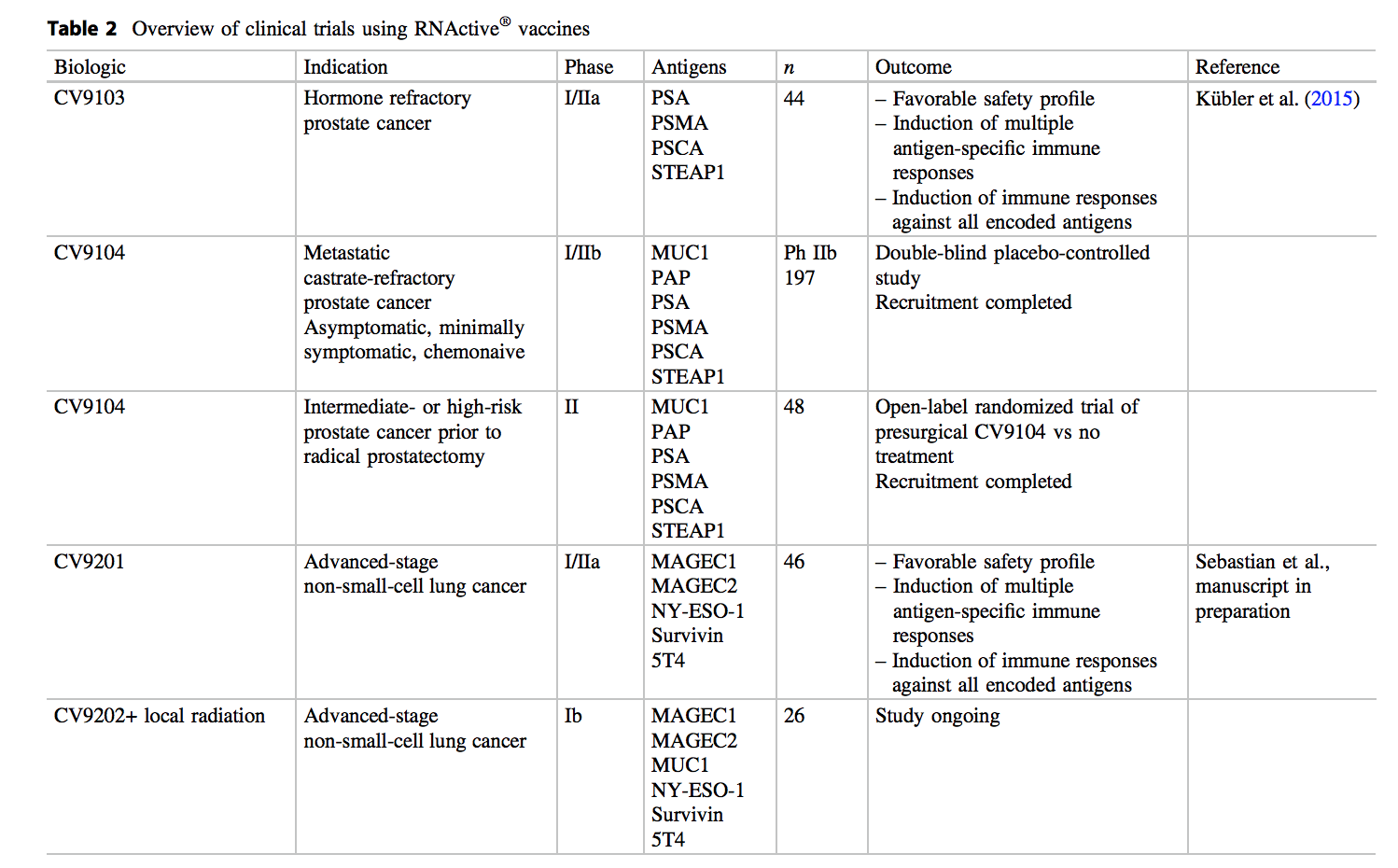
基于令人鼓舞的临床前结果,决定将该技术推进癌症患者的临床测试(表2)。使用mRNA作为治疗方法的一流的首次人类临床试验是针对前列腺癌患者的CV9103。CV9103是RNActive ®针对以下4种与肿瘤相关的抗原的疫苗:前列腺特异性抗原(PSA),前列腺特异性膜抗原(PSMA),前列腺干细胞抗原(PSCA)和前列腺1的六跨膜上皮抗原(STEAP1)。在I / IIa期研究中对该疫苗进行了测试,该研究招募了44名合格的去势抵抗性前列腺癌患者,其中84%的患者PSA水平升高(所有患者)且有转移性疾病,其中I期的12名男性和32岁的男性IIa期研究(Kübler等2015年)。这项研究是作为一项开放,不受控制,多中心,国际和前瞻性试验进行的,其安全性和耐受性定义为主要终点,而诱导抗原特异性的体液和细胞免疫应答为次要终点。建议剂量是通过I期试验中的剂量递增确定的(测试的总RNA为259、640和1280 µg),而IIa期研究旨在确认安全性并解决诱导抗原特异性细胞和体液免疫反应的问题最高剂量注射后。这项研究表明,CV9103具有良好的安全性,最常见的不良事件是注射部位反应,疲劳,发热,发冷和类似流感的症状。大多数相关的不良事件为轻度至中度,经治疗可缓解。
重要的是,可以检测到针对所有mRNA编码抗原的免疫反应,而与抗原的细胞定位和患者的HLA亚型无关。更具体地说,在接受最高剂量治疗的所有患者中,有76%检出了抗原特异性细胞免疫应答。值得注意的是,在最高剂量水平下,有58%的反应患者和45%的所有可评估患者显示出对多种抗原的反应。体液免疫反应的评估仅限于PSA和PSCA,因为当时没有适合ELISA的蛋白质可用于其他疫苗接种抗原。在12%的患者中可以检测到PSA特异性抗体的增加,但是未观察到抗PSCA抗体的增加。
CV9103的临床疗效主要通过PSA血清水平的进展来评估,因为本项临床试验未评估无影像学无进展生存期(PFS)。与其他癌症疫苗试验相似,与PSA相关的PFS的中位时间为1.8个月,仅观察到一名患者的客观PSA反应。
此外,研究估计36名转移性去势抵抗性前列腺癌患者亚组的中位生存期为31.4个月。在该组中,观察到存活时间与多价免疫反应之间无显着相关性。有趣的是,对多种疫苗接种抗原有反应的患者的预后进一步改善。然而,针对一种以上抗原的免疫应答与存活时间的改善之间的相关性并不一定意味着疫苗的治疗作用。接种疫苗后引发免疫反应的能力可能替代了预后的改善(Kübleret al。2015年)。
然而,这些令人鼓舞的结果合理RNActive调查®疫苗在临床对照试验。因此,在一项正在进行的由CV9104进行的安慰剂对照IIb期研究中,将197名去势抵抗性无症状至无症状去势抵抗性前列腺癌的患者纳入研究并随机分组。这种更新的疫苗基于CV9103,编码另外两个与肿瘤相关的抗原,即前列腺酸磷酸酶(PAP)和粘蛋白1(MUC1),一种在多种癌症(包括前列腺癌)中过度表达和糖基化的糖蛋白。PAP作为疫苗抗原的临床疗效和安全性先前已在Sipuleucel-T的临床试验中得到证实(Kantoff等。2010年),而MUC1主要用于具有非凡安全性的非小细胞肺癌的免疫疗法中(Palmer et al。 2001)。研究的主要终点是随机分组后的总生存期(最长3.5–4年)。次要终点分别包括从随机分组之日起以及从随后的首次全身治疗开始起的PFS,针对CV9104抗原的免疫应答,症状发展的时间以及生活质量的改变。
在第二项研究中,CV9104在患有高危和中危非转移性前列腺癌的患者中进行了测试。对于这些患者,根治性前列腺切除术是一种标准的治疗选择。手术后,估计复发的风险相当大,在手术切缘阳性的情况下甚至更大。因此,迫切需要能够预防主要治疗后复发的新辅助治疗或新辅助治疗。
该研究旨在评估外周血的免疫反应以及肿瘤组织中的免疫学参数,例如应用CV9104时的细胞免疫浸润,细胞因子和基因表达。
除了其在前列腺癌的治疗中的应用,RNActive ®疫苗还测试如在临床阶段I / IIA试验对非小细胞肺癌的免疫治疗(NSCLC)(塞巴斯蒂安等人,手稿在准备中) 。
在这项研究中,以不同剂量皮内注射免疫治疗性CV9201,以评估晚期NSCLC患者的安全性和耐受性。CV9201编码5种与NSCLC相关的癌症抗原,这些抗原是根据其在NSCLC肿瘤发生中的作用,恶性组织与正常组织之间的差异表达并诱导细胞或体液免疫反应而选择的:纽约食道鳞状细胞癌1(NY-ESO-1),黑素瘤抗原家族C1(MAGEC1),黑素瘤抗原家族C2(MAGEC2),存活蛋白和滋养层糖蛋白(TPBG;同义词5T4)。符合条件的患者在一线治疗后患有IIIB / IV期NSCLC,且疾病至少稳定。在开放,不受控制,多中心和前瞻性试验中,研究的9例患者在I期接受CV9201,在IIa期接受37例患者。全面的,45/46位患者接受了至少两种治疗,而33/46位患者接受了所有五种计划剂量的CV9201。这项研究表明,与CV9103相似,CV9201也显示出良好的安全性,最常见的不良事件是注射部位反应,包括注射部位红斑,瘙痒,变色和疼痛。其他与治疗相关的不良事件包括发热,疲劳,发冷和类似流感的症状。此外,可检测到针对所有编码抗原的免疫应答。详细地说,所有患者中有65%表现出抗原特异性的细胞或体液免疫应答,而65%的应答者对多种抗原有反应。诱导的T细胞反应的强度各不相同,但大多数患者离体检测到的抗原特异性T细胞的频率和数量均增加了两倍以上,一些患者表现出非常强烈的反应。此外,在IIa期接受治疗的患者中,有48%的患者具有抗原特异性的体液反应,与IgG反应相比,表现出IgM的患者多于两倍。
可以评估29例患者的肿瘤反应,其中9例疾病稳定,20例患者进行性疾病为最佳总体反应。总研究人群中的PFS中位数为2.7个月。重要的是,该研究揭示了5例IV期NSCLC患者的令人鼓舞的临床过程,这些患者在1年后没有进一步的系统性癌症治疗。
总体而言,这些结果表明,RNActive ®疫苗代表一种大有希望的新疫苗平台,它是安全的,非常具体的,通用的,并且能够诱导临床研究的背景下,平衡免疫反应。
1.2.3 组合RNActive的®疫苗与化疗或放疗
从临床角度看,重要的是评估是否RNActive是重要®疫苗可与目前的护理标准相结合。因此,研究了这些疫苗与化学疗法或放射疗法的组合。
使用多西他赛或顺铂以及针对卵清蛋白的mRNA疫苗在E.G7-OVA肿瘤模型中测试了与化学疗法的结合。
已经接收皮下肿瘤攻击随后RNActive ®接种,将小鼠随后用多西紫杉醇腹膜内应用随后进一步接种处理。导致肿瘤生长的显著延迟相比,多西他赛或RNActive这种治疗时间表®单独疫苗。当使用相同的治疗方案但顺铂作为化疗药物时,观察到相似的结果。与发表的使用病毒载体疫苗的结果一致(Garnett et al。2008年),在疫苗接种之前进行化学疗法后无法检测到肿瘤生长的延迟,这表明多西紫杉醇在免疫反应的诱导阶段具有负面作用(Fotin-Mleczek等。 2012年)。
一个有趣的选择是疫苗接种与放射治疗相结合,因为这两种方法具有互补性,可以协同作用来限制肿瘤的生长。放射线是一种行之有效的治疗方法,尤其是用于治疗单个实体瘤。它在局部作用于肿瘤组织,并且在很短的时间内,由于促炎性细胞因子的释放增加而对具有局部免疫抑制环境的肿瘤有效(福门汀和德马里亚2013年)并诱导局部MHC表达(Reits等人, 2006年)。此外,放疗诱导的细胞死亡似乎代表了一种免疫原性细胞死亡,其特征是钙网蛋白的细胞表面易位以及ATP和高迁移率族框1(HMGB1)蛋白在细胞外释放(Golden等,2014年)。这些因子能够通过模式识别受体激活树突状细胞(DC),并促进DC和T细胞(Demaria和Formenti)之间肿瘤抗原的交叉呈递。2012年)。
另一方面,疫苗接种能够诱导针对持久且可加强的非症状性转移性疾病的全身性免疫应答。
因此,放射治疗和RNActive的组合®疫苗在E.G7-OVA肿瘤模型中测试。在建立大的皮下肿瘤之后,小鼠在连续的几天接受了三个局部辐射。与此同时,与OVA-RNActive几个接种®疫苗给药。这些实验证明了在联合治疗组中有明显的肿瘤消退,并在7只小鼠中的3只中完全根除了大的已建立的E.G7-OVA肿瘤,而单一疗法的疗效仍然明显较低(Fotin-Mleczek等。2014年)。作为第二个肿瘤系统,在Lewis肺癌(LLC)模型中进行了另外的实验,该系统具有低免疫原性并且对不同种类的治疗方案具有抵抗力(Savai等人。2007年; Shojaei等。2007年; 纳普(Knapp)等人。2003年)。皮下肿瘤攻击后,小鼠用在组合在连续天数三个本地辐射处理具有若干接种与RNActive ®编码所描述的肿瘤相关抗原EGFR和连接蛋白疫苗(Mandelboim等。1995年)。联合治疗显示出协同的抗肿瘤作用,即使在免疫原性低的癌症模型系统中也证明了放射免疫疗法的有效性(Fotin-Mleczek等。2014年)。
1.2.4 与RNActive临床研究®与放疗联合疫苗
基于有为的临床前结果,一个Ib期研究正在进行,评估RNActive的临床潜力®疫苗CV9202结合个人转移为巩固和维持治疗患者的IV期非小细胞肺癌的局部辐射。CV9202是CV9201的更新版本,除NY-ESO-1,MAGEC1,MAGEC2,survivin和5T4外还编码抗原MUC1。如前所述,糖蛋白MUC1(在各种癌症中过度表达并异常糖基化)先前已用于针对非小细胞肺癌的免疫治疗方法中(Palmer et al。2001)。这项探索性,开放标签的多中心试验评估了CV9202疫苗联合局部放疗对不同亚型IV级NSCLC患者(有或无EGFR突变的鳞状和非鳞状细胞)在治疗后达到缓解或稳定疾病的安全性和耐受性一线疗法(化学疗法或EGFR酪氨酸激酶抑制剂)。在局部放疗之前,所有患者均接受了两次CV9202初始疫苗接种,随后进行了进一步的疫苗接种直至疾病进展。该研究的主要终点是经历3级以上与治疗相关的不良事件的患者人数。次要终点包括评估对CV9202编码的抗原和疫苗未涵盖的抗原的细胞和体液免疫反应,从而研究响应该治疗的潜在抗原扩散。此外,对PFS的评估,开始二线癌症治疗的时间,对二线治疗的反应以及总体生存率是研究的次要疗效终点(Sebastian等。2014年)。
1.2.5 组合RNActive的®与免疫抑制剂的检查站疫苗
对癌症的免疫反应发展了许多年,最终由于免疫编辑(MHC I和免疫原性抗原的下调)和免疫逃避(免疫抑制性微环境)而失败(Vesely和Schreiber 2013年)。此外,抗肿瘤免疫应答具有慢性免疫应答的许多特征,其中T细胞衰竭是由免疫检查点受体介导的,例如程序性细胞死亡1(PD1)。除活化的T细胞外,PD1还由B细胞,NK细胞和调节性T细胞表达,并与两个不同的配体PDL1(B7-H1)和PDL2(B7-DC)结合。相反,免疫检查点受体细胞毒性T淋巴细胞抗原4(CTLA-4)仅由活化的T细胞或调节性T细胞表达,其配体CD80(B7-1)或CD86(B7-2)的结合导致抑制通过拮抗CD28在T细胞活化过程中传递的共刺激信号来抑制T细胞的分化(Melero et al。2015年)。
靶向这些免疫检查点的各种抗体目前正在临床测试中,对某些患者显示出可喜的结果。但是仍然有相当一部分患者对免疫检查站封锁没有反应。最新发表的研究表明,抗原特异性T细胞的出现与对免疫检查点封锁的反应之间有很强的相关性(在Schumacher和Schreiber中进行了综述)2015年)。因此,通过免疫接种诱导针对肿瘤相关抗原的抗原特异性细胞应答在免疫检查点封锁治疗期间将是有益的。测试是否关卡抑制剂还可以与基因疫苗,一个RNActive结合®疫苗与抗CTLA-4抗体结合。用E.G7-OVA肿瘤攻击小鼠,并用编码卵白蛋白的mRNA疫苗和抗CTLA-4抗体交替治疗。联合使用可显着降低肿瘤的生长,而单独使用抗CTLA-4治疗不会延迟肿瘤的生长。另外,用治疗导致完全排斥的小鼠用缺乏OVA表达的亲代肿瘤细胞系再次攻击。这些实验表明,尽管如此,小鼠仍受到了完全保护,强烈表明诱导了抗原决定簇的扩散(Fotin-Mleczek et al。2012年)。
总之,RNActive的优异的抗肿瘤反应®于与免疫检查点封锁组合疫苗治疗可以在临床前动物模型中得到证明。
1.3 个性化mRNA疫苗
过去,癌症疫苗的开发主要致力于所谓的肿瘤相关蛋白作为抗原来源。通常,这些与肿瘤相关的抗原可分为两类:
-
源自在癌细胞中过度表达的胎儿(fetal)基因的抗原(van der Bruggen等人。1991年; Van den Eynde等。1991年)
-
源自组织特异性蛋白质的抗原也可在癌细胞中表达(Boon等。 1994年)。
为了提供广泛适用的针对癌症的免疫疗法,癌症疫苗领域的最新发展活动集中于共享的肿瘤相关抗原,这些抗原不仅在不同类型的癌症中大量表达,而且在一定数量的癌症患者中表达。
但是,使用这种共享的肿瘤相关抗原具有某些缺点:
- 首先,T细胞容易识别外源抗原,但由于胸腺中的负选择过程,通常无法识别自身抗原,从而阻止了自身免疫的诱导。不幸的是,大多数与肿瘤相关的抗原都属于自身抗原,阻碍了针对这些抗原的适当免疫反应的启动。
- 其次,肿瘤相关抗原未在肿瘤组织中单独表达,导致通过诱导的免疫反应在健康组织中可能产生靶向作用。最后,由于正常的生物学异质性,不同肿瘤组织或不同癌症患者中肿瘤相关抗原的表达可能高度可变。2011年),甚至在亚克隆水平上,在某些肿瘤中也可以发现高变异性(Gerlinger等人。 2015年; Martincorena等。2015年)。
因此,可以假设共享的肿瘤相关抗原的表达具有相似的可变性。此外,肿瘤组织通常利用不同的逃逸机制来逃避抗肿瘤免疫反应,例如肿瘤相关抗原的下调或非表达克隆的优先生长(Matsushita等人。2012年)。
由于明显的原因,使用真正的肿瘤特异性抗原或新抗原代替肿瘤相关抗原将有利于癌症疫苗的开发:由于这些新抗原的肿瘤特异性突变,特异性T细胞库不受阴性影响在胸腺中的选择。此外,新抗原特异性T细胞不会对健康组织产生靶向作用,因为突变抗原仅在癌细胞中表达。在1970年代和1980年代,已经在可移植的肿瘤模型中描述了新抗原诱导的免疫反应的抗肿瘤能力(Boon和Kellermann1977年; Lurquin等。1989年)。此外,不同的研究可能表明,定义基因中的单个突变能够诱导抗原特异性的溶细胞性T细胞反应(Wölfel等。1995年; Coulie等。1995年; Echchakir等。2001)。
近年来,新一代测序技术的出现使如今的这种肿瘤特异性抗原或新抗原的定义是通过将单个患者的肿瘤组织与健康组织的基因组,外显子组或转录组数据进行比较。这种方法允许描述仅在肿瘤细胞中表达的非同义突变。此外,外显子组或转录组分析允许对肿瘤组织中已定义的非同义突变定义蛋白质丰度。由单个肿瘤显示的这种肿瘤特异性突变的集合体,也称为“突变组”,是高度肿瘤特异性抗原的宝贵来源。
两项针对小鼠的研究提供了第一个直接证据,即通过诱变分析鉴定出的新抗原可以被T细胞识别(Castle et al。 2012年; 松下等。2012年)。简而言之,针对所有肿瘤特异性突变预测了潜在的MHC结合肽,这些突变导致形成新的蛋白质序列,并且最有希望的突变肽用于询问体内T细胞反应性。Castle及其同事可以证明,在50种突变编码肽中,有16种在免疫小鼠中引起了可测量的免疫反应。而且,诱导的免疫应答在B16F10肿瘤模型中赋予了显着的抗肿瘤作用。在Matsushita等人的研究中,已证明一种计算机模拟的,源自突变体血影蛋白-β2的高度免疫原性新抗原足以在未编辑的肿瘤中诱导肿瘤细胞消除。
随后在临床中的研究已经为新抗原诱导显着的抗肿瘤免疫反应的能力以及通过诱变采矿的这种新抗原的可预测性提供了更多的证据。Robbins和同事可以通过挖掘外显子组测序数据来鉴定被过继转移的肿瘤反应性T细胞识别的新抗原(Robbins等。2013年),而van Rooji及其同事通过肿瘤外显子组分析在ipilimumab反应性黑色素瘤中发现了新抗原特异性T细胞反应性(van Rooij等人。 2013年)。尤其是,最近几年的一些出版物中已经证明了成功的免疫检查点封锁与肿瘤特异性新抗原的出现之间的相关性。Gubin及其同事鉴定了抗PD1或抗CTLA-4治疗的肉瘤逐渐生长的小鼠的新抗原。此外,他们可能表明掺入这些突变表位的治疗性合成长肽疫苗能够诱导与免疫检查点封锁相当的肿瘤排斥反应(Gubin等。2014年)。Snyder等人的结果甚至更有趣。和Rizvi等。证实在患有非小细胞肺癌或黑色素瘤的患者中,抗PD1或抗CTLA-4治疗对克隆性新抗原的丰度与免疫检查点阻断的敏感性之间存在密切的相关性。此外,在两项研究中,预测的新抗原都引发了特定的CD8 + T细胞反应(Snyder等人。2014年; Rizvi等。2015年)。同样,对于黑色素瘤患者中采用过继性肿瘤浸润淋巴细胞转移的治疗方法,还发现了新抗原负荷量与治疗效果之间的相似相关性(Lu等。2014年; Linnemann等。2015年)。此外,Tran及其同事可以提供证据证明在上皮癌患者中基于突变特异性CD4 + T细胞的免疫疗法是可能的(Tran等。2014年)。
上述研究和其他一些出版物证明了肿瘤外显子组挖掘的可行性以及基于HLA同种异型和肽结合概率的免疫原性预测,以多种方法鉴定不同类型癌症中患者特异性高免疫原性新抗原的可能性(Rajasagi等。 2014年; 段等。2014年; Yadav等。2014年; Tran等。2015年)。此外,经常暗示了这种新抗原对于个性化免疫治疗方法的潜在价值(Gubin et al。2014年; Tran等。2014年)。在癌症患者中特异性靶向新抗原的一种可能性是改造新抗原特异性T细胞受体并过继转移这些T细胞(Leisegang et al。2016年)使用此处也介绍的方法。另一个选择是用掺入新抗原突变序列的疫苗进行免疫。目前正在I阶段IDH1R123H突变的III–IV级神经胶质瘤(NCT02454634)的I期临床试验中评估这种使用肽的免疫方法的功效。这项临床研究基于Schumacher及其同事发表的结果,该结果显示了在荷瘤的MHC人源化小鼠中突变IDH1肽疫苗的抗肿瘤潜力(Schumacher et al。2014年)。但是,突变IDH1似乎是一个独特的例外,因为该突变经常在弥散的II级和III级神经胶质瘤中发现。
新抗原的这种高渗透性似乎与其他肿瘤实体相反。在大多数人类肿瘤中,大部分突变不会以有意义的频率在患者之间共享。此外,在表达的基因中只有一小部分突变具有导致T细胞反应性的抗原潜能(Lu等。2014年; Linnemann等。2015年)。由于这些局限性,在巨大的患者群体中用于疫苗接种的广泛适用的新抗原是极不可能的。因此,mRNA疫苗代表了一种更好的方法,可以满足基于新抗原的个性化免疫疗法的特定需求。上面已经提到了与肽疫苗相比,mRNA疫苗的明显优势。特别地,在明确定义和受控的条件下通过体外转录的生产以及通过共同的过程并且在相对短的时间内生产针对不同新抗原的疫苗的可能性满足了个性化免疫疗法方法的要求。
在Kreiter及其同事的最新研究中,在鼠肿瘤模型中证明了基于新抗原的RNA疫苗的抑瘤特性。原则上,诱变分析和MHC结合预测可导致对某些新表位具有体内免疫原性的新表位的选择。另外,与编码未经治疗的小鼠相比,用编码一种B16特异性新抗原的mRNA疫苗对荷瘤小鼠进行免疫,导致免疫小鼠的存活率显着提高。对于临床环境,在一种疫苗中结合几种新抗原将更可解决肿瘤的异质性和免疫编辑,而这种异质性和免疫编辑可能会介导人类疫苗的临床失败。最近证明,静脉注射后CT26肺转移的免疫治疗2015年)。
基于这些令人信服的结果,2014年开始了针对黑色素瘤患者的第一期I期临床试验,其中针对目标患者的独特突变特征,注射了一种编码新neuropitope的RNA疫苗(NCT02035956)。此外,于2015年建立了第二项临床试验,使用略有不同的方法治疗三阴性乳腺癌(NCT02316457)。
总之,通过mRNA疫苗诱导新抗原特异性T细胞反应性似乎是成功的癌症免疫疗法的有前途的策略。由于靶向抗原的肿瘤限制表达,这些个性化的抗肿瘤疗法有望提供高度特异性和安全性。另外,用这种个性化免疫疗法可以实现的T细胞反应性将进一步增加对癌症免疫疗法有反应的人类恶性肿瘤的范围。特别地,免疫检查点封锁与新抗原负荷之间的相关性暗示了个性化癌症免疫疗法与检查点封锁相结合的协同作用。
1.4 细胞疫苗:mRNA脉冲树突状细胞
mRNA转染的树突状细胞(DC)疫苗代表了涉及RNA的独特疫苗策略。在不同类型的抗原呈递细胞(APC)中,DC被认为是最有效的DC,因为它们可以有效地引发幼稚T细胞,从而刺激适应性免疫应答。由于其在体外和体内均可诱导有效的抗肿瘤CTL,DC已被用作癌症疫苗接种平台。该治疗策略的基础是使用表达肿瘤相关抗原(TAA)的癌症患者DC来激活抗原特异性T细胞,该抗原在细胞毒性效应T细胞分化后将能够根除肿瘤细胞,而不论其位置如何。而且,这些T细胞可以形成免疫记忆,以这种方式提供对复发性癌细胞的防御。
为了将肿瘤抗原递送至DC,mRNA被认为是一种有吸引力的载体,因为它克服了与使用抗原衍生肽相关的一些局限性,抗原衍生肽是抗原加载最常用的策略(Cerundolo等。 2004年; 舒勒等。2003年; Jager等。2002年)。合成肽仅代表已知TAA中确定的表位,并且取决于患者的先前鉴定和HLA限制,这意味着疫苗诱导的免疫反应仅限于所用的肽,并且只有具有特定HLA同种异型的患者才能接受治疗( Van Nuffel等。2012年)。相反,mRNA分子可以编码整个肿瘤抗原。因此,可以呈现同一蛋白质内的多个免疫原性表位。此外,由于蛋白质是在DC的mRNA转染后内源表达和呈递的,因此会生成多种肽-MHC复合物(pMHC)。因此,疫苗的开发与患者的遗传背景无关。
Boczkowski及其合作者是在1990年代后期首次描述用编码肿瘤抗原的mRNA脉冲的DC是有效的抗原呈递细胞(Boczkowski et al。 1996年)。仅仅几年后,一项使用带有编码PSA的RNA的DC的早期临床试验证明了这种方法的可行性和安全性。确实在某些患者中诱导了对表达PSA的转移性前列腺肿瘤的CTL反应(Heiser等。2002年)。这种方法基于DC的被动脉冲,这依赖于这些细胞通过微胞吞作用吸收mRNA的能力(Diken等。2011年)。但是,这种机制涉及转运到内体中,因此存在这样的风险,即只有一部分mRNA可以到达细胞质,然后可以翻译成蛋白质。因此,已经建立了几种方法来将mRNA直接传递到细胞质中,例如电穿孔,核转染,脂质转染以及最近的声穿孔(Benteyn等。2015年)。最重要的是,电穿孔已被证明是一种将肿瘤抗原引入DC的强大技术(Van Tendeloo et al。2001)。
编码特异性TAA或总肿瘤RNA的mRNA可用于转染DC。使用转染了定义的TAA mRNA的DC的疫苗策略避免了患者特异性肿瘤细胞的生长,并降低了自身免疫的风险,而自身免疫可以通过存在正常表达的自身蛋白来诱导(Nair et al。1999年; Ponsaerts等。2003年)。但是,由于对于许多癌症而言,TAA是未知的,因此存在一些局限性。一个有吸引力的替代方法是利用用患者来源的总肿瘤RNA转染的DC。通过这种方法,显示了肿瘤特异性抗原的整个谱图,从而消除了对TAA鉴定的需要,并允许免疫系统使用最有效的抗原,同时降低了逃避突变体的风险。使用肿瘤来源的RNA作为全肿瘤抗原来源的另一个优势是可以通过RT-PCR快速,轻松地从少量肿瘤中扩增出它(Heiser等。2002年)。
迄今为止,已经报道了使用mRNA转染的DC的一些临床试验。这些研究大多数都表明,在几种肿瘤实体中,如脑癌,黑素瘤,肺腺癌,肾细胞癌和卵巢癌,mRNA转染的DC可以诱导肿瘤特异性T细胞应答(Bonehill等人。2009年; Caruso等。2004年, 2005年; Kyte等。2007年; Nair等。2002年; Su等。2003年; 莫尔斯(Morse)等人。2003年; Dannull等。2005年; Van Nuffel等。2012年)。特别是,在Su等人进行的肾细胞癌研究中,患者没有显示剂量限制性毒性或自身免疫诱导的证据(Su等人。2003年)。同样,分别在9位和7位患者中进行的脑肿瘤和神经母细胞瘤研究显示,总共有3位患者有临床反应。
尽管在mRNA-DC免疫疗法方面取得了许多进展,但是临床反应仍然不多,并且正在探索如何增强mRNA-DC疫苗功效的新策略。除了传递肿瘤抗原外,mRNA还可用于传递可调节DC功能的蛋白质。DC与编码TAA的mRNA和共刺激分子(例如CD83)共转染(Aerts-Toegaerr等。2007年),OX40(Dannull等, 2005年)和4-1BBL(Grünebachet al。 2005年)已显示可在临床前模型中改善mRNA-DC疫苗的功效。此外,通过电穿孔激活的DCs编码四种肿瘤抗原的mRNA以及编码CD40配体以及组成型活性TLR4和CD70的mRNA(TriMix-DCs)在化学难治性晚期黑色素瘤患者中产生广泛的T细胞反应和持久的肿瘤反应(Van Nuffel等al。2012年)。DC也已经用编码免疫调节细胞因子的mRNA修饰。例如,转染编码IL-12和TAA的mRNA的DCs被证明可以诱导高细胞毒性T细胞并增强其效应子功能。此外,DCs的迁移能力已使用编码嵌合E / L-选择素的mRNA进行了调节,该策略导致静脉内给药后DCs向淋巴结的迁移增加(Dörrieet al。2008年)。
最后,进一步的临床前策略集中在通过共同施用用TAA编码的mRNA或编码拮抗性抗CTLA-4或激动性抗GITR抗体的mRNA转染的DC来增强DC功能(Pruitt等人。 2011年)。因此,改造的DC不仅具有呈递感兴趣的肿瘤抗原的能力,而且还具有局部调节免疫检查点和肿瘤微环境的能力。由于临床前研究的结果令人鼓舞,因此目前正在治疗黑色素瘤患者的I期临床试验中对该方法进行研究(NCT01216436)。
综上所述,这些策略具有改善癌症免疫疗法的潜力。
1.5 CAR T细胞
嵌合抗原受体(CAR)T细胞免疫疗法最近已成为治疗肿瘤的一种有前途的策略(Cheadle et al。 2012年; Restifo等。2012年; Kershaw等。2013年)。
CAR T细胞是使用患者来源的T细胞进行个性化细胞治疗的一种形式。收集T细胞后,对它们进行基因工程改造,使其表达受体,从而使它们能够识别出患者癌细胞表达的特定抗原,并在将细胞重新注入患者体内后攻击肿瘤。嵌合受体通常由与细胞内T细胞信号传导域融合的细胞外TAA特异性抗体结合域组成。可以对CAR T细胞进行改造,使其几乎靶向任何与肿瘤相关的抗原(Jensen和Riddell2015年)。
由于CARs基于TAA特异性抗体结合域,因此肿瘤抗原的识别是非HLA依赖性的,从而将其适用性扩展到许多患者,并克服了一些肿瘤逃逸机制(Ramos和Dotti 2011年)。
经过工程改造以表达CAR的转基因T细胞的过继转移在血液系统恶性肿瘤的治疗中已显示出早期有希望的结果(Kochenderfer等。 2012年; 布伦特尼斯(Brentjens)等人。2013年; 波特等。2011年; Grupp等。2013年)。但是,到目前为止,CAR T细胞在治疗实体癌方面不太成功,主要问题之一是毒性。确实,临床试验已经揭示了工程改造的T细胞识别和攻击共享肿瘤CAR特异性抗原表达的正常细胞的潜力,从而引起脱靶毒性(Lamers等。2006年, 2013年; 毛斯等。2013年)。
修饰T细胞的主要方法是使用病毒载体,例如γ逆转录病毒和慢病毒,它们生产成本高昂,并且涉及与整合到基因组中有关的安全性问题(Kershaw等人。 2013年)。
最近,mRNA电穿孔已被用于改造具有瞬时CAR表达的T细胞。宾夕法尼亚大学佩雷尔曼医学院的June教授及其同事率先证明了这种方法的可行性以及mRNA修饰的T细胞在临床前肿瘤模型中诱导强大的抗肿瘤作用的潜力(Zhao等。2010年; Barett等。2011年, 2013年)。
因此,他们进行了第一项临床试验,以评估在患者中重复输注mRNA CAR T细胞的可行性和安全性(Beatty等。 2014年)。两名患者(一名患有晚期间皮瘤,另一名患有转移性胰腺癌)被招募进入I期临床试验。研究人员使用mRNA电穿孔技术,通过特异靶向间皮素(Tmeso细胞)的CAR改造患者来源的T细胞(一种在几种癌症中过表达的TAA)。在确保其生存力和特异性之后,将工程化的T细胞重复注入患者体内。出人意料的是,在这两名患者中均显示出抗肿瘤活性的临床和实验室证据,而没有针对正常组织的非肿瘤毒性的明确证据。除抗肿瘤活性外,CAR Tmeso细胞还能够触发与表位扩散一致的广泛抗肿瘤免疫反应。
最近,mRNA不仅用于改造T细胞以识别特定的TAA,而且还用于将修饰的端粒酶逆转录酶(TERT)瞬时递送至CD19 CAR T细胞。这项研究提供了一种有效和安全的方法来延长T细胞复制寿命,从而与传统的CAR T细胞相比,以这种方式改善CAR T细胞在B细胞恶性小鼠异种移植肿瘤模型中的持久性和抗肿瘤作用(Bai等。2015年)。
所有这些发现支持mRNA工程化T细胞的发展,将其作为过继细胞转移的新方法,为治疗癌症提供了灵活的平台,可补充逆转录病毒和慢病毒工程化T细胞的使用。
二、结论
mRNA在编码TAA,患者来源的肿瘤新抗原或嵌合抗原受体中的多功能性使mRNA疫苗成为用于癌症免疫治疗的有希望的候选者。最初的临床研究令人鼓舞的结果促使人们对增加疫苗免疫原性的策略进行了深入研究,其中包括对mRNA的修饰,应用或与其他治疗方法(如检查点抑制剂或放射疗法)的结合。这些努力有望在癌症治疗中带来新的治疗选择,这将充分利用mRNA疫苗的独特特性。
参考资料
- Current Strategies in Cancer Gene Therapy pp 61-85. mRNA Cancer Vaccines. https://link.springer.com/chapter/10.1007%2F978-3-319-42934-2_5
