【7.3.1】减轻对流感病毒的原始抗原原罪( original antigenic sin)反应的策略
原始抗原原罪(Original antigenic sin)是一种现象,其中连续暴露于密切相关的流感病毒变体会降低抗体 (Ab) 对第二毒株中新抗原决定簇的反应,从而损害免疫记忆的发展。这可能会对先前感染或接种流感疫苗的人的免疫记忆的发展构成风险。在这里,我们探索了在小鼠中克服原始抗原原罪反应的策略,这些小鼠依次暴露于两种密切相关的血凝素 1 神经氨酸酶 1 (H1N1) 流感病毒株 A/PR/8/34 和 A/FM/1/47。
- 我们发现树突状细胞激活佐剂 [百日咳博德特氏菌毒素 (PT) 或 CpG ODN 或基于角鲨烯的水包油纳米乳剂 (NE)],在第二次病毒暴露期间给药后,完全保护小鼠免受致命挑战并增强针对第二种病毒的中和抗体滴度。
- 有趣的是,在第一次免疫接种期间施用 PT 和 NE 佐剂时,甚至可以在没有任何佐剂的情况下防止后续免疫中的原始抗原原罪。
- 作为使用佐剂的替代方法,我们还发现用第二种病毒株重复免疫可以减轻原始抗原原罪的影响。
总之,我们的研究提供了至少三种克服原罪的方法。
一、前言
最初由 Thomas Francis ( 1 )于 1953 年描述的原始抗原原罪是一种现象,在这种现象中,连续暴露于病毒变体会优先 诱导对过去遇到的病毒株产生Ab 反应。结果,对当前株的响应减弱。在过去的五年中,已经在人类以及其他哺乳动物(例如小鼠、雪貂和兔子)中观察到原始抗原原罪 ( 2 – 5 )。这种现象可能引起人们对流感疫苗接种计划的人类免疫反应的关注。因此,需要制定策略来克服抗原原罪。
有趣的是,原始抗原原罪让人想起称为载体介导的半抗原抑制(carrier-mediated hapten suppression)的免疫学现象,Herzenberg 及其同事于 1980 年首次描述 ( 6 )。他们表明,在先前暴露于载体蛋白锁孔血蓝蛋白 (KLH) 的小鼠中,使用半抗原(二硝基苯基)偶联的 KLH 进行第二次免疫导致对半抗原的 Ab 反应的选择性抑制 ( 6 )。这种选择性抑制并非半抗原载体系统的小鼠模型所独有。先前接种破伤风疫苗并随后接受由与破伤风结合的疟疾子孢子肽组成的疫苗的人类志愿者显示抗疟疾反应受到抑制(7). 在 1998 年的研究之前,这种表位抑制的确切机制一直是个谜,Moser 及其同事对载体介导的半抗原抑制的细胞基础提供了重要的见解 ( 8 )。他们表明,在二次免疫期间,注射用半抗原载体加 IL-12 脉冲的树突细胞 (DC) 后,半抗原特异性 Ab 反应得到改善。他们得出结论,激活 DC 并强制 T 辅助 (Th)1 反应可以克服载体介导的半抗原特异性抑制。
成熟激活的 DC 充当免疫系统的先天性和适应性臂之间的纽带,并且此过程可由多种细菌成分促进 ( 9 , 10 )。在这些细菌产品中,灭活的百日咳博德特氏菌是一种有效的佐剂 ( 11 ),其成分包括百日咳杆菌毒素 (PT) 和百日咳杆菌内毒素 (LPS) 已显示可阻断或逆转载体介导的半抗原抑制 ( 12 , 13). 具体而言,PT 刺激 DC 上调 MHC II 类和共刺激分子 [分化簇 (CD)80、CD86、CD40 以及树突状和上皮细胞 (DEC)205],以产生 IL-12 和 TNF-α,并向上调节-调节 ERK ( 14 ) 的磷酸化。PT 的这种整体 DC 激活通过促进 T 细胞产生 IFN-γ 引发 Th1 反应。含有未甲基化 CpG 二核苷酸的细菌 DNA 也是 Th1 反应和细胞毒性 T 细胞反应的强佐剂 ( 15 , 16 )。与 PT 类似,CpG 在促进 Th1 样免疫反应中的作用 ( 17 , 18) 是 DC 成熟的结果,导致 DC 表面上的 MHC II 类、B7 和 CD40 分子上调以及 IL-12、IL-6 和 TNF-α 的产生 ( 19 )。因此,两种佐剂的作用机制都归因于 DC 的有效激活。
对于佐剂的人类应用,经过验证的安全性和有效性记录至关重要。尽管有效的 DC 激活和解除半抗原抑制的能力,但出于安全考虑,PT 或 CpG 不适合临床应用。因此,基于角鲨烯的水包油纳米乳(NE)代表了更适合人类应用的佐剂。到目前为止,两种 NE 佐剂 MF59 和 AS03 已在欧洲获批用于人类,但在美国尚未获批。尽管确切的作用机制尚不清楚,但研究表明,NE 通过将 DC 募集到注射部位并促进细胞因子的产生,同样可以增强先天免疫力 ( 20 , 21 )). 几项临床研究表明,NE 增强了灭活流感疫苗的免疫原性,同时被接受者很好地耐受 ( 22 – 25 )。由于 NE 还诱导针对流感病毒异亚型株的交叉反应 ( 23 , 24 ),因此测试该佐剂是否可以克服/减少原抗原原罪具有临床意义。
这项研究的目的是制定策略来克服对流感病毒的原始抗原性反应。注意到原始抗原原罪和载体介导的半抗原抑制之间的相似性,我们假设施用 DC 激活佐剂可以减轻原始抗原原罪。使用我们最近建立的小鼠模型 ( 26),在这里,我们表明在连续暴露于两种密切相关的血凝素 1 神经氨酸酶 1 (H1N1) 流感病毒株 A/Puerto Rico/8/34 (PR8) 和 A/ Fort Monmouth/1/47 (FM1),克服了抗原原罪。在用 FM1 进行致命攻击后,肺部病毒滴度无法检测到或降低就证明了这一点。这归因于产生 IFN-γ 的记忆 CD4 和 CD8 T 细胞的激活以及针对 FM1 的更高中和抗体滴度。
- 有趣的是,PT 和 NE,但不是 CpG,当在初次暴露期间施用时,阻止了原始抗原原罪对变异病毒的诱导。
- 最后,我们表明可以通过使用相同剂量的第二种流感病毒 FM1 进行加强免疫而无需任何佐剂来克服原始抗原原罪。
二、结果
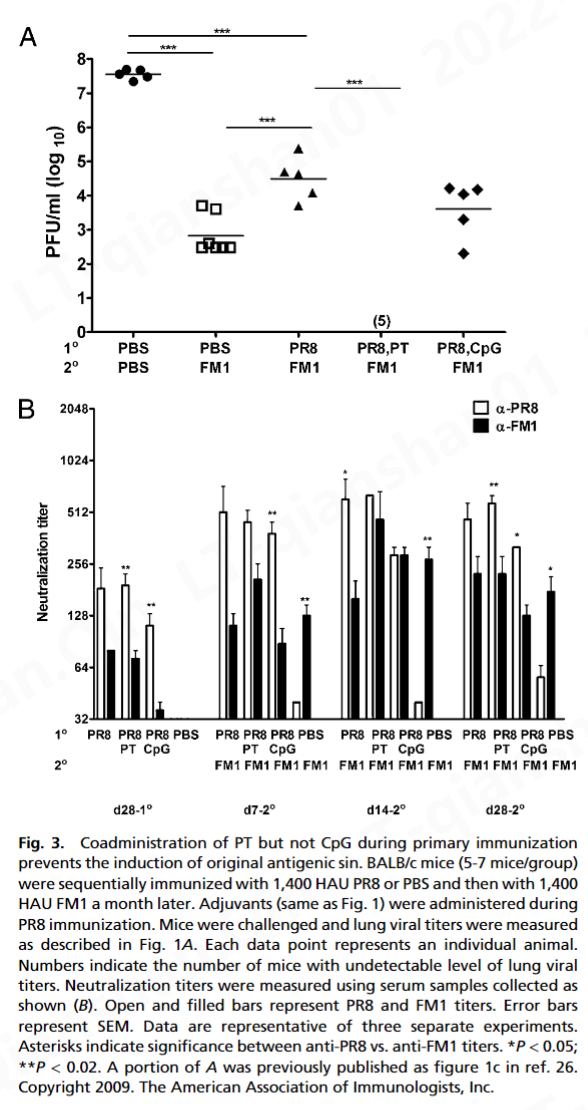
而 FM1 免疫(免疫控制)显着降低了肺病毒滴度(7 × 10 2pfu/mL) 与幼稚小鼠 (5 × 10 7 pfu/mL) 相比,顺序免疫小鼠的肺病毒滴度 (3 × 10 4 pfu/mL) 显着高于免疫对照小鼠。这表明原始抗原原罪损害了免疫记忆的建立。形成鲜明对比的是,佐剂组的肺病毒滴度检测不到,表明在第 4 天完全保护免受致死攻击。这些数据表明 PT 或 CpG 在用变体流感病毒连续免疫期间克服了原始抗原原罪。
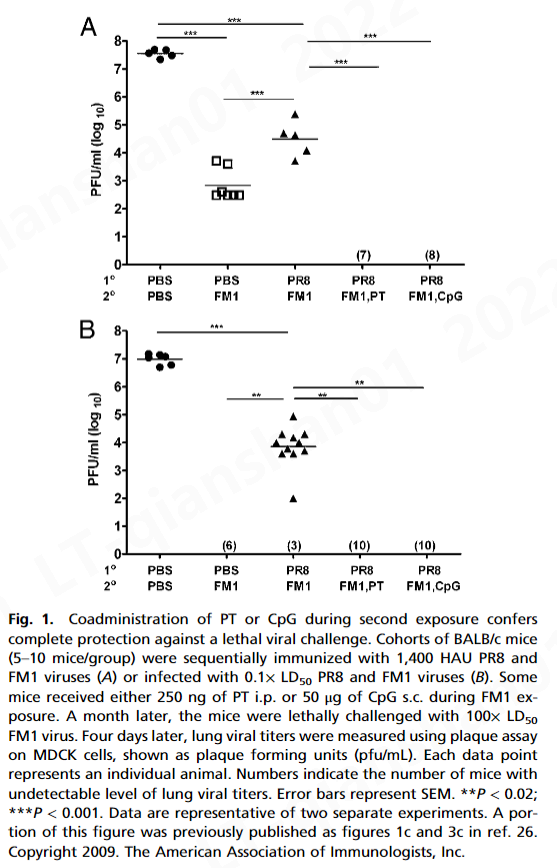
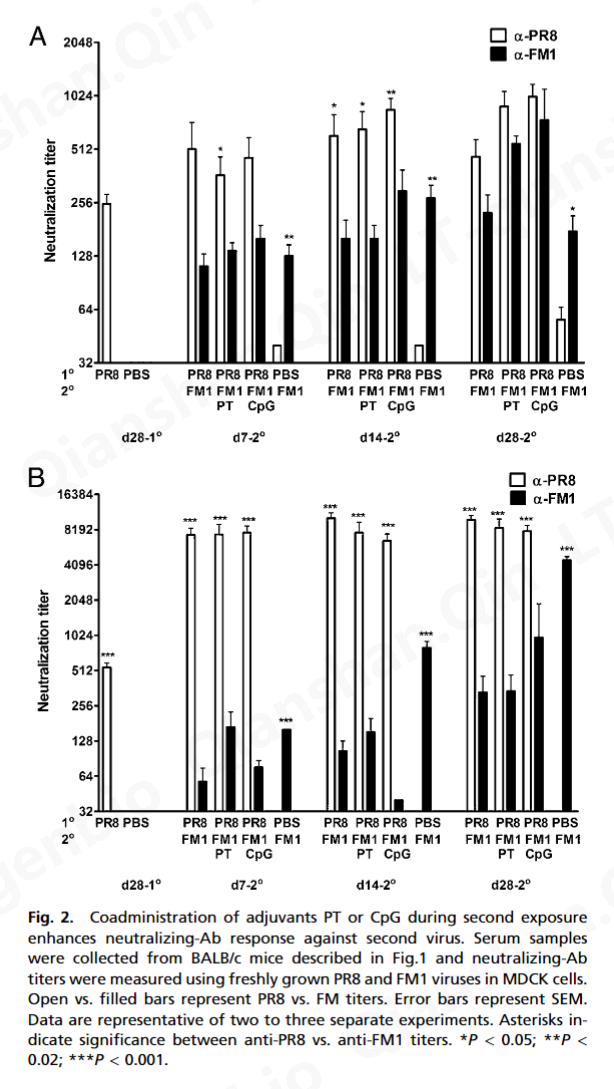
三、讨论
原抗原原罪的确切机制仍然难以捉摸。原始抗原原罪的发生可能是由于预先存在的记忆 B 细胞而不是 DC 呈递抗原。在连续接触 PR8 和 FM1 的情况下,初次接触会诱导 PR8 表位特异性 B 细胞和交叉反应性 B 细胞的增殖。暴露于 FM1 后,交叉反应性记忆 B 细胞的选择性激活可能会以 FM1 新型表位特异性幼稚 B 细胞为代价,因为与幼稚 B 相比,交叉反应性记忆 B 细胞的频率更高且激活阈值更低细胞。此外,唾液酸结合可以促进记忆 B 细胞与 HA 的结合(31). 所有这些因素都会导致记忆 B 细胞摄取和呈递银。B 细胞而不是 DC 对 Ag 呈递的这种重定向可能会导致次优的激活信号,这有利于记忆而不是幼稚的 B 细胞激活。
佐剂的施用可以将 Ag 呈递从记忆 B 细胞转移到 DC 并增强细胞免疫反应。PT 和 CpG 均促进 DC 的成熟,诱导它们产生包括 IL-12 和 IFN-γ 在内的细胞因子,并增强 Ag 呈递 ( 14 , 17 , 19 , 32 )。NE 增强免疫原性的机制尚不完全清楚,但现有数据表明 MF59 通过在注射部位接触肌肉细胞触发局部炎症环境,然后间接激活 DCs ( 20). 不管对 DC 的直接影响如何,DC 的激活可以将 Ag 呈递从记忆 B 细胞转移到 DC,导致更多的 FM1 特异性幼稚 B 细胞募集到反应中。因此,DC 的参与可能对克服抗原原罪至关重要。检验这一假设的实验目前正在进行中。
病毒的立即中和是由预先存在的中和抗体介导的 ( 33 )。然而,包括 Ag 特异性 CD8 T 细胞在内的细胞免疫对于病毒清除至关重要 ( 34 , 35 )。据此,我们观察到佐剂显着增强了病毒特异性 CD8 和 CD4 T 细胞反应(图 4)。我们的数据表明,在初次或二次暴露期间接受 PT 或 CpG 的小鼠表现出增强的或完全的保护免受致命挑战(图 1和3A )。这不仅归因于针对 FM1 的抗体滴度增强(图 2和3 B),但也激活产生 IFN-γ 和 IL-4 的记忆 CD8 T 细胞(图 4)。因此,可以想象佐剂通过激活 DC,可以增强记忆 CD8 T 细胞的细胞毒性作用以加速病毒清除,同时激活产生 IFN-γ 的 CD4 T 细胞以帮助中和抗体反应。有趣的是,PT 比 CpG 产生更多数量的产生 IL-4 的 CD4 T 细胞(图 4 B),这可以解释为什么在第一次暴露期间给予 PT 的小鼠比 CpG 组产生更好的保护反应(图 3 A) .
最后,我们的研究结果提出了第三种克服抗原原罪的策略。用第二种病毒株重复免疫诱导了对第二种病毒的强烈反应(图 6)。在用 DNA 疫苗或完整灭活病毒顺序免疫的小鼠中,在记忆阶段用相同剂量的 FM1 加强动物显着增强了针对 FM1 的抗体滴度(图 6)。因此,重新暴露有助于记忆池的发展和对变异株的保护性免疫。这可能通过二次暴露期间产生的 FM1 特异性 B 细胞的选择性激活而发生。 随着每年的流感疫苗接种,原抗原原罪的威胁隐约可见,尤其是相关的流感病毒。我们目前的研究提供了通过使用佐剂或加强免疫来预防或减少原始抗原原罪的策略。尽管这些方法为了解抗原原罪的机制提供了一些线索,但诱导抗原原罪的综合分子机制还有待更详尽的研究。
参考资料
