【2.2】病毒定量
病毒定量涉及计算特定体积中的病毒数量以确定病毒浓度。它用于商业和学术实验室的研发 (R&D) 以及各个步骤的病毒数量是重要变量的生产情况。例如,病毒疫苗的生产、使用病毒载体和病毒抗原的重组蛋白都需要病毒量化以不断调整和监测过程,以优化生产产量并响应不断变化的需求和应用。需要对已知病毒进行量化的具体实例包括克隆筛选、感染复数 (MOI, multiplicity of infection ) 优化和细胞培养方法的适应性。本页讨论了目前用于量化液体样本中病毒的各种技术。这些方法分为两类,传统方法与现代方法。传统方法是已使用数十年的行业标准方法,但通常速度慢且劳动强度大。现代方法是相对较新的市售产品和试剂盒,可大大缩短量化时间。这并不意味着对所有可能的方法进行详尽的审查,而是对传统方法和新的商业可用方法的代表性总结。虽然可能存在其他已发布的病毒量化方法,但此处不讨论非商业方法。
一、感染性粒子量化的传统方法
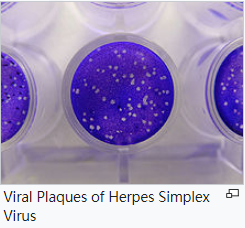
1.1 斑块分析 Plaque assay
基于斑块的测定是用于根据感染剂量确定病毒浓度的标准方法。 病毒斑块测定确定病毒样本中斑块形成单位(pfu,plaque forming units ) 的数量,这是衡量病毒数量的一种方法。该测定基于在培养皿或多孔板中进行的微生物学方法。具体来说,汇合的单层(a confluent monolayer)宿主细胞被不同稀释度的病毒感染,并覆盖有半固体培养基,如琼脂或羧甲基纤维素,以防止病毒感染肆意传播。当病毒感染固定细胞单层内的细胞时,就会形成病毒斑块。[1] 被病毒感染的细胞会裂解并将感染传播到相邻的细胞,在那里重复感染到裂解的循环。受感染的细胞区域会形成一个斑块(被未感染细胞包围的感染区域),可以用光学显微镜或肉眼观察(倒掉覆盖培养基并加入结晶紫溶液 15 分钟,直到它使细胞质着色,用水轻轻去除多余的部分将显示无色的死细胞位置[2]). 斑块形成可能需要 3-14 天,具体取决于所分析的病毒。噬菌斑通常是手动计数的,结果结合用于制备平板的稀释因子,用于计算每样品单位体积的噬菌斑形成单位数 (pfu/mL)。pfu/mL 结果代表样本中感染性颗粒的数量,并且基于这样的假设:形成的每个噬菌斑代表一个感染性病毒颗粒。[3] [4]
1.2焦点形成试验 (FFA, Focus forming assay)

被轮状病毒感染的细胞(上)和未感染的细胞(下) 病灶形成试验 (FFA) 是斑块试验的一种变体,但 FFA 不是依靠细胞裂解来检测斑块形成,而是采用免疫染色技术,使用对病毒抗原具有特异性的荧光标记抗体在实际斑块形成之前检测受感染的宿主细胞和感染性病毒颗粒。FFA 对于量化不裂解细胞膜的病毒类别特别有用,因为这些病毒不适合斑块测定。与噬菌斑测定一样,宿主细胞单层细胞被各种稀释的病毒样本感染,并在限制传染性病毒传播的半固体覆盖介质下孵育相对较短的潜伏期(例如 24-72 小时),从而产生局部化受感染细胞的簇(病灶)。随后用针对病毒抗原的荧光标记抗体探测板,并使用荧光显微镜来计数和量化病灶的数量。 但就所需的试剂和设备而言,它可能更昂贵。测定完成时间还取决于用户计数的区域大小。更大的区域将需要更多时间,但可以提供更准确的样本表示。FFA 的结果表示为每毫升焦点形成单位,或 FFU/mL。[5]
1.3 终点稀释试验 Endpoint dilution assay
TCID50(50% 组织培养感染剂量,50% Tissue Culture Infectious Dose)测定是感染病毒滴度的量度。该终点稀释测定可量化杀死 50% 感染宿主或在 50% 接种组织培养细胞中产生细胞病变效应所需的病毒量。这种测定在临床研究应用中可能更常见,在这些应用中必须确定病毒的致死剂量或病毒是否不形成噬菌斑。当用于组织培养时,宿主细胞被铺板并加入病毒的连续稀释液。孵育后,手动观察和记录每个病毒稀释度的细胞死亡百分比(即感染细胞),结果用于数学计算 TCID 50结果。[5] [6]由于检测方法和原理的明显差异,TCID 50和 pfu/mL 或其他感染性检测结果并不等同。由于细胞感染时间,此方法可能需要长达一周的时间。[7]
通常用于计算 TCID 50的两种方法(也可用于计算其他类型的 50% 终点,例如EC50、IC50和LD50)是:
- 斯皮尔曼-克伯[8]
- Reed-Muench 方法
基于泊松分布,概率分布它描述了在固定空间(孔中病毒培养基的数量)中可能发生多少以已知平均速率(病毒滴度)发生的随机事件(病毒颗粒),TCID 50和 PFU 之间的理论关系约为 0.69 PFU = 1 TCID50。 然而,必须强调的是,在实践中,即使对于相同的病毒 + 细胞组合,这种关系也可能不成立,因为两种类型的检测方法不同,病毒感染性对细胞年龄、覆盖介质等各种因素非常敏感等。但以下参考文献对这种关系的定义不同:假设使用相同的细胞系统,病毒在这些细胞上形成斑块,并且没有添加会抑制斑块形成的程序,则预计会有 1 mL 的病毒储备大约一半的斑块形成单位 (PFU) 为 TCID 50. 这只是一个估计,但基于以下基本原理:通常预计会感染 50% 受攻击细胞层的有限稀释最初会在被感染的细胞层中产生单个噬菌斑。在某些情况下,两个或多个斑块可能偶然形成,因此 PFU 的实际数量应通过实验确定。
从数学上讲,预期的 PFU 会略大于 TCID 50 的二分之一,因为 TCID 50中的负管代表零个斑块形成单位,而每个正极管代表一个或多个斑块形成单位。通过应用泊松分布可以获得更精确的估计。
因此,可以将 TCID50滴度(每毫升)乘以 0.7 来预测 PFU/ml 的平均数。在实际应用此类计算时,请记住,与 TCID 50所用条件下的表达相比,如果可视化斑块所需的协议变化不会改变传染性病毒的表达,则计算出的平均值才有效。
因此,作为一项工作估计,可以假设 TCID50 为 1 × 10^5 TCID50 /mL 的材料将产生 0.7 × 10^5 PFU/mL。 [10]
1.4 蛋白质分析
基于蛋白质的病毒定量分析有多种变体。通常,这些方法量化样本中所有蛋白质的量或特定病毒蛋白的量,而不是量化受感染细胞或病毒颗粒的数量。定量最常依赖于荧光检测。一些测定变化直接量化样品中的蛋白质,而其他变化需要宿主细胞感染和孵育以允许病毒在蛋白质量化之前生长。使用的变化主要取决于初始样品中蛋白质(即病毒)的量和检测本身的灵敏度。如果需要孵化和病毒生长,通常在分析之前进行细胞和/或病毒裂解/消化。大多数基于蛋白质的方法相对快速且灵敏,但需要质量标准来进行准确校准和量化蛋白质,而不是实际的病毒颗粒浓度。以下是广泛使用的基于蛋白质的检测的具体示例。 铁汉 14:22:52
1.4.1 血凝试验 Hemagglutination assay
血凝试验 (HA) 是一种常见的非荧光蛋白定量分析,专门针对流感。它依赖于血凝素(流感病毒的一种表面蛋白)凝集红细胞(即导致红细胞聚集在一起)这一事实。在此测定中,将流感样本的稀释液与 1% 的红细胞溶液一起孵育一小时,然后目测确定首次发生凝集的病毒稀释液。该测定产生血凝单位 (HAU, hemagglutination units) 的结果,典型的 pfu 与 HAU 比率在 10^6范围内。[11] [12] [13] 该检测需要约 1-2 小时才能完成,结果可能因操作员的技术专长而有很大差异。
血凝抑制测定是用于测量血清中流感特异性抗体水平的 HA 测定的常见变体。在这种变异中,流感病毒的血清抗体会干扰病毒与红细胞的结合。因此,当抗体以足够浓度存在时,血凝作用会受到抑制。[14]
1.4.2 二辛可宁酸测定 Bicinchoninic acid assay
二喹啉甲酸测定 (BCA) 基于简单的比色测量,是最常见的蛋白质定量测定。BCA 类似于Lowry或Bradford蛋白质测定,最初由 Pierce 商业化,现在由Thermo Fisher Scientific拥有。在 BCA 测定中,蛋白质的肽键将 Cu2+定量还原为 Cu1+,从而产生淡蓝色。BCA以 2:1 的比例螯合Cu 1+,产生颜色更深的物质,在 562 nm 处吸收。 吸光度样品在 562 nm 的波长用于确定样品中的大量蛋白质浓度。在用分光光度计或读板器分析后,将测定结果与已知的标准曲线进行比较。[15] 总测定时间为 30 分钟到 1 小时。虽然这种检测方法普遍且快速,但它缺乏特异性,因为它计算所有蛋白质,要量化的病毒制剂必须含有非常低水平的宿主细胞蛋白质。
1.4.3 单径向免疫扩散试验 Single radial immunodiffusion assay
单径向免疫扩散试验(SRID),也称为曼奇尼法,是一种通过在半固体培养基(如琼脂)中进行免疫扩散来检测特定病毒抗原量的蛋白质试验。该培养基含有对感兴趣的抗原具有特异性的抗血清,抗原位于圆盘的中心。当抗原扩散到培养基中时,它会产生一个沉淀环,该环会一直生长直到达到平衡。取决于抗原和抗体的平衡时间,测定时间可以从 10 小时到几天不等。环的区域直径与蛋白质浓度的日志线性相关,并与已知蛋白质标准的区域直径进行比较以进行量化。[16] 市售有用于该测定的试剂盒和血清(例如 The Binding Site Inc.)。
1.4.4 透射电子显微镜 (TEM,Transmission electron microscopy)
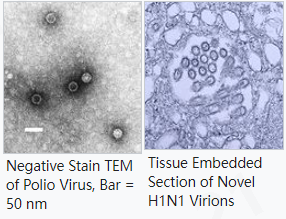
TEM是一种特殊类型的显微镜,它利用磁场聚焦的电子束对样品进行成像。TEM 提供的成像空间分辨率比光学显微镜高 1000 倍(分辨率低至 0.2 nm)。[17]需要 超薄负染色样品。样品制备包括将样品沉积到带涂层的 TEM 网格上,并使用电子不透明液体进行负染色。[18] 如果切成薄片,也可以检查组织包埋的样本。样品制备因协议和用户而异,但通常需要数小时才能完成。TEM 图像可以显示单个病毒颗粒和定量图像分析可用于确定病毒浓度。这些高分辨率图像还提供大多数其他方法无法提供的粒子形态信息。定量 TEM 结果通常会大于其他测定的结果,因为所有颗粒,无论传染性如何,都在报告的每毫升病毒样颗粒 (vlp/mL) 结果中进行量化。定量 TEM 通常适用于大于 10 6颗粒/mL 的病毒浓度。由于高昂的仪器成本以及所需的空间和支持设施,TEM 设备在有限数量的设施中可用。
二、量化病毒颗粒的现代方法
2.1 可调电阻脉冲传感 (TRPS,Tunable resistive pulse sensing)
可调电阻脉冲传感 (TRPS) 是一种允许对单个病毒颗粒进行高通量单颗粒测量的方法,因为它们被驱动通过尺寸可调的纳米孔,一次一个。[19]该技术的优点是可以同时以高分辨率确定溶液中病毒颗粒的大小和浓度。这可用于评估样品稳定性和聚集体的贡献,以及总病毒颗粒浓度 (vp/mL)。[20]
基于 TRPS 的测量发生在离子缓冲液中,分析前不需要对样品进行预染色,因此该技术比需要用荧光染料预处理的技术更快,总准备和测量时间少于每个样品 10 分钟。基于 TRPS 的病毒分析可通过qViro-X 系统在市场上获得,该系统能够在测量后通过高压灭菌进行化学净化。
2.2 流式细胞术
虽然大多数流式细胞仪没有足够的灵敏度,但有一些市售的流式细胞仪可用于病毒定量。病毒计数器使用荧光检测共定位的蛋白质和核酸来量化样品中完整病毒颗粒的数量。样品用两种染料染色,一种专用于蛋白质,一种专用于核酸,并在它们流过激光束时进行分析。确定在两个不同荧光通道中的每一个上产生同时事件的粒子数量,以及测量的样本流速,以计算病毒粒子的浓度 (vp/mL)。[21] 结果在绝对数量上通常与 TEM 结果相似。该测定的线性工作范围为 10^5 –10^9 vp/mL,分析时间约为 10 分钟,样品制备时间较短。
2.3 单病毒电感耦合等离子体质谱 (SV ICP-MS)
该技术类似于 Degueldre 和 Favarger (2003) [22]发现的单粒子电感耦合等离子体质谱 (SP ICP-MS),后来适用于其他纳米粒子,例如金胶体,参见 Degueldre 等人 (2006)。[23]在 Degueldre (2021) 的一项综合研究中,SP ICP-MS 适用于分析单病毒电感耦合等离子体质谱 (SV ICPMS)。[24]本研究建议将此方法用于单个病毒 (SV) 识别和计数。通过 SV 检测模式下的高分辨率多通道扇形场 (MC SF) ICP-MS 记录,主离子和关键离子的计数可以分析和识别单个病毒。可在 20 秒内完成 2-500 维里单位的计数。建议在 Ar 炬管中对以下主离子进行分析:12C+、13C+、14N+、15N+ 以及关键离子 31P+、32S+、33S+ 和 34S+。详细讨论了所有干扰。建议使用高分辨率 MC ICP-MS,同时探索厌氧/好氧气氛选项以升级使用四极杆 ICP-MS 时的分析。
2.4 定量聚合酶链反应 (qPCR)
定量 PCR 利用聚合酶链反应化学来扩增病毒DNA或RNA,以产生足够高的浓度以通过荧光进行检测和定量。一般来说,qPCR 的定量依赖于已知浓度标准品的连续稀释,同时分析未知样品以进行校准和参考。定量检测可以使用多种荧光检测策略来实现,包括序列特异性探针或非特异性荧光染料,如SYBR Green。[25] 序列特异性探针,如TaqMan(由 Applied Biosystems 开发)、分子信标或 Scorpion,仅与反应过程中产生的适当序列的 DNA 结合。SYBR Green 染料与反应过程中产生的所有双链 DNA [26]结合。虽然 SYBR Green 易于使用,但其缺乏特异性和较低的灵敏度导致大多数实验室使用基于探针的 qPCR 检测方案。qPCR 有许多变体,包括比较阈值方法,它允许通过比较来自包含内部标准的多个样本的 Ct 值(显示产物在统计上显着增加的 PCR 循环)进行相对量化。[27] PCR扩增所有目标核酸,包括源自完整传染性病毒颗粒、缺陷病毒颗粒以及溶液中游离核酸的病毒。因此,qPCR 结果(以基因组拷贝/mL 表示)的数量可能高于 TEM 结果。对于病毒定量,完整病毒粒子与核酸拷贝的比率很少是一比一的。这是因为在病毒复制过程中,核酸和病毒蛋白并不总是以 1:1 的比例产生,病毒组装过程会产生完整的病毒粒子以及空衣壳和/或过量的游离病毒基因组。以口蹄疫病毒为例,在活跃复制的宿主细胞中,完整病毒粒子与 RNA 拷贝的比例约为 1:1000。[28]用于基于 qPCR 的病毒滴定的产品可通过许多公司(例如 Invitrogen、Roche 或 Qiagen)商购获得。通过 qPCR 进行滴定的优点包括快速周转时间(1-4 小时)和灵敏度(可以检测到比其他方法低得多的病毒浓度)。
2.5 酶联免疫吸附测定 (ELISA)
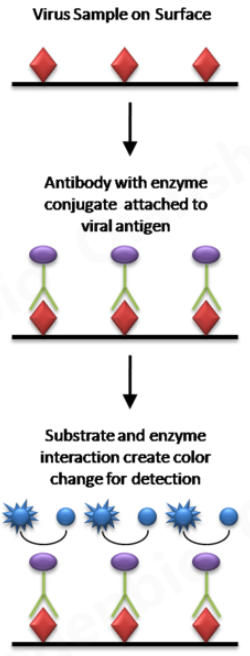
ELISA是一种更现代的蛋白质测定变体,它利用与酶连接的特异性抗体来检测样品中是否存在未知量的抗原(即病毒)。通过酶将试剂转化为可用于计算样品中抗原浓度的可检测信号的能力来检测和/或量化抗体-抗原结合事件。[29] 辣根过氧化物酶(HRP) 是 ELISA 方案中常用的一种酶,因为它能够放大信号并提高检测灵敏度。ELISA 检测有多种变体或类型,但通常可分为间接、竞争、夹心或反向. [30] ELISA 试剂盒可从许多公司购买,并且通常通过显色报告基因或荧光(例如 Invitrogen、Santa Cruz Biotechnology Inc.)进行量化。与传统方法相比,这种技术的劳动强度要低得多,根据抗体孵育时间的不同,可能需要 4 到 24 小时。
参考资料
