【8.5.4】新的腺相关病毒的体内导向进化为玻璃体外治疗外视网膜基因
遗传性视网膜退行性疾病是腺相关病毒(AAV)介导的基因治疗的临床前景。这些疾病起因于在眼睛的感光细胞或视网膜色素上皮细胞(RPE)中表达的mRNA转录物的致病突变,导致细胞死亡和结构清除。因为目前的基因递送方法需要有害的视网膜下注射,以达到光受体或RPE并仅转导视网膜的一部分,所以它们仅适用于治疗视网膜结构保持完整的罕见退行性疾病。为了满足广泛适用的基因递送方法的需要,我们实施了体内指导进化以设计AAV变体,其在注射到眼睛容易接近的玻璃体液中后将基因货物递送到外视网膜。这种方法对于致密组织穿透构成基因递送障碍的情况具有一般意义。得到的AAV变体介导向外视网膜的广泛递送,并在相应的小鼠模型中挽救了X-连锁的视网膜劈裂和Leber的先天性黑朦的疾病表型。此外,它能够从玻璃体(vitreous)中转导灵长类动物光感受器,从而扩大其治疗前景。
一、前言
视网膜变性的遗传形式,在全世界1/3000人中受到影响,主要来自眼睛最外层视网膜层细胞的突变(图1)。 这些包括光感受器细胞 - 在脊椎动物眼睛的视网膜中的光检测神经元 - 或视网膜色素上皮细胞(RPE) - 位于光感受器外侧并支撑光感受器的一层色素细胞。 因此,外部视网膜是眼部基因治疗的主要目标,其通常通过使用腺相关病毒(AAV)载体将突变基因的野生型拷贝递送至合适的细胞(转导)。
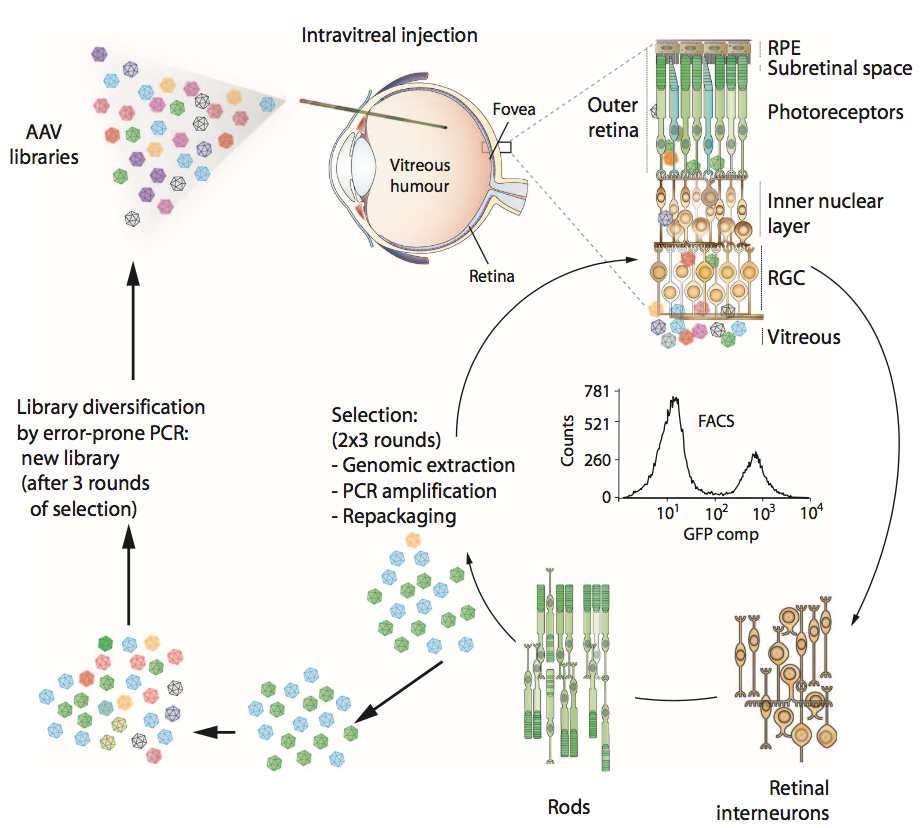
图1.用于产生病毒变体的体内指导进化过程的示意图。 创建了三个库:容易出错的AAV2 Y444F库 ( error-prone AAV2 Y444F library ),AAV改组库( AAV shuffled library )和随机7mer插入库( random 7mer insertion library )。 每个文库具有10^7的多样性,并且它们以相等的部分混合并玻璃体内注射到成年转基因rho-GFP小鼠眼中。 注射后一周,摘除眼睛并使用温和的木瓜蛋白酶酶处理解离视网膜,然后进行FACS分离光感受器(代表性的FACS图)。 然后从基因组提取物中PCR扩增来自分离细胞的病毒cap基因(代表来自成功转导光感受器的文库的AAV变体)用于克隆和重新包装。 一轮演变包括初始文库多样化,然后是三个选择步骤。 RGCs,视网膜神经节细胞; RPE,视网膜色素上皮细胞。
目前的基因递送载体需要施用到RPE和光感受器之间的视网膜下空间,以转导这些神经元。为了实现载体的递送,针必须穿透视网膜,并且在这样做时,将感光细胞层与RPE分离。视网膜疾病2型Leber’s先天性黑蒙(LCA2)最近的三项临床试验使用视网膜下注射将AAV携带视网膜异构酶编码基因RPE65传递给RPE;试验方案得益于LCA2的非典型病理学,LCA2表现出光敏功能的丧失多年来没有显着的视网膜层结构破坏。相比之下,大多数视网膜退行性疾病(包括视网膜色素变性和黄斑变性,占所有视网膜变性病例的一半)的特征在于感光细胞的逐渐丧失和整个视网膜上越来越脆弱的视网膜结构。在这种疾病状态下,视网膜下手术可引起机械损伤,反应性神经胶质增生和功能丧失。在一项LCA2试验中甚至记录了这些程序效应,因为在中央凹区域接受视网膜下注射的患者失去了视网膜厚度和视力;这些结果使研究人员得出结论,LCA基因治疗在中央凹视网膜中是有效的,但在治疗中央凹方面没有任何益处和一些风险。
X连锁视网膜劈裂(XLRS)是一种视网膜退行性疾病,由外视网膜中表达的转录物突变引起,适合临床基因治疗。 XLRS突变存在于编码视网膜劈裂蛋白的基因中,并导致特别严重的结构异常和视力受损。 这种从光感受器中分泌的蛋白质是维持正常视网膜组织所必需的,包括光感受器 - 双极细胞突触。 XLRS敲除小鼠的基因治疗研究,视网膜色素(Rs1h)无效,说明XLRS基因替代治疗对患者的挑战。 玻璃体内和视网膜下方法已用于在该模型中递送携带Rs1h基因功能性拷贝的AAV。 然而,光感受器仅通过视网膜下注射有效转移,这限制了治疗效果的区域并且在注射部位引起手术破坏。
视网膜退行性疾病患者视网膜,对视网膜下手术的耐受程度取决于突变的性质和手术后视网膜变性的阶段。 另外一个问题是,由于外部视网膜缺损在整个组织中表达,因此有效的治疗方法应该是视网膜全视网膜或沿视网膜的整个宽度到达细胞; 视网膜下注射仅转导与注射液的局部“泡”接触的细胞。 因此,需要新的递送技术将基因转移到视网膜的更深层。 这种技术可能对治疗人体疾病具有更广泛的意义,这些疾病涉及由于物理(例如,扩散和膜)和细胞屏障(例如内皮细胞)导致的AAV无法获得的结构复杂组织内的细胞。
为了赋予AAV克服这种复杂组织屏障的能力,我们开发了一种体内指导的进化策略,使我们能够迭代地富集能够从玻璃体到达外部视网膜的AAV变体。 在这里,我们描述了一种进化的AAV变体(7m8),其介导了对小鼠和非人灵长类动物中所有视网膜层的高效递送。 7m8还在两种视网膜疾病小鼠模型中介导治疗性基因递送至光感受器,从而实现整个视网膜中疾病表型的非侵入性,长期组织学和功能性拯救。 这些发现对于LCA2,视网膜劈裂和其他视网膜疾病的基因疗法的开发具有重要且立即临床相关的意义,所述视网膜疾病需要稳健的泛视网膜基因表达而没有视网膜脱离。
二、结果
天然存在的AAV血清型不能从视网膜的玻璃体侧转导光感受器,因为内部限制膜(ILM)和介入的神经元和神经胶质细胞以及内部视网膜的过程(图1)形成强大的扩散屏障。 AAV颗粒的丰富结合位点,在啮齿动物和灵长类动物中几百微米厚。表面暴露酪氨酸残基的比例诱变,允许AAV颗粒避免细胞内泛素化和降解,通过改善的细胞内核运输增加玻璃体内光感受器基因的传递,从而表明AAV2具有感染光感受器的部分能力。然而,减少细胞内泛素化是继发于感染期间载体遇到的实质性物理屏障的继发因素,在这种情况下可能包括病毒隔离,ILM扩散不良,细胞外空间和介入细胞层,或两者兼而有之。
2.1 文库筛选收敛于一个主导变体
为了在玻璃体内注射时开发能够外部视网膜基因递送的AAV,我们设计了体内指导的进化方法(图1)。使用三个AAV文库,每个文库的多样性为10^7:AAV2衣壳蛋白(帽)编码文库,其中随机七个氨基酸序列插入衣壳的环4(在肝素结合结构域内);编码经历随机诱变的AAV2基因组的酪氨酸突变体形式的文库(AAV2 Y444F EP);和通过改组AAV1,2,4,5,6,8和9产生的嵌合衣壳编码文库。将文库组合并玻璃体注射到转基因小鼠的眼睛中,所述转基因小鼠在其视杆细胞感受器中特异性地表达视紫红质 - 绿色荧光蛋白(GFP)融合体。优化荧光激活细胞分选(FACS)以在文库注射后1周从收获的视网膜中分离纯的GFP阳性光感受器。然后通过聚合酶链式反应(PCR)从这些神经元中回收成功的AAV帽变体,并再次包装病毒。进行另外两个这样的选择步骤,然后进行易错PCR以将更多的多样性引入文库,并进行另外三个体内选择步骤。
在该扩展的进化过程之后,对48个变体cap基因进行测序(图2A)。 值得注意的是,这些克隆中有46个来自AAV2七氨基酸肽(7聚体,7mer)插入文库,其中31个含有相同的七氨基酸基序(LGETTRP)(尴尬了,为啥这里的7肽,图里面的是9肽,专利里面是10肽?)。 下一个最突出的变体(46个中的5个)含有相似的基序(NETITRP),在极性苏氨酸和非极性脯氨酸残基(TRP)之间具有带正电荷的精氨酸残基。 这表示从~107个输入变体到单个显性共有序列的收敛。 此外,来自7mer文库的46个克隆中有34个含有V708I突变。 我们专注于其中一个突出的克隆,7m8,用于深入表征。

图2. 7m8的进化变体和结构模型的表征。 (A)进化变体的测序揭示了所选病毒库中的高度收敛。 除了两个取样的变体之外的所有变体都来自AAV2七氨基酸文库,并且67%的所有克隆(48个中的32个)含有相同的7mer基序(LGETTRP)。 未列入表格的其余部分仅在数据中出现一次。 (B至D)在氨基酸587之后含有插入LALGETTRP(以橙色显示)的AAV2的分子模型。插入的环与衣壳的其他表面环之间的相互作用可能在病毒的新特性中起作用。
我们模拟了7m8的主要衣壳蛋白,即AAV2~588LALGETTRP,叠加在其亲本AAV2上(图2B)。 588LALGETTRP插入破坏了环4中的碱性精氨酸残基,其涉及AAV2与其主要受体硫酸乙酰肝素蛋白多糖(HSPG)的结合(图2,C和D)。 此外,肽在环4中的位置和与环3的接近(也参与受体结合)使其处于进一步改变病毒向性的位置。 使用7m8包装携带编码GFP(7m8-GFP)的基因的重组病毒,并在体外分析其聚糖依赖性(图S1A)。 7m8感染仍然是HSPG依赖性,尽管其肝素亲和力低于AAV2(图S1B)。 此外,与AAV2一样,7m8没有表现出唾液酸依赖性; 然而,它在中国仓鼠卵巢(CHO)细胞系中比AAV2具有> 10至100倍的传染性。
。。。
三、讨论
我们的结果阐述了通过7m8来实现视网膜基因治疗,治疗 影响视网膜内外视网膜的遗传性视网膜变性。 更广泛地说,这项工作表明,具有设计用于克服临界生物转运和转导障碍的特性的工程化AAV载体变体,有望产生影响临床基因治疗的复杂组织的多种疾病。
当视网膜结构完整时,LCA2基因治疗的具有里程碑意义的临床试验支持通过AAV载体进行视网膜基因转移的安全性和有效性;然而,大多数退化的视网膜恶化使得在这些临床试验的成功基础上建立起来具有挑战性。我们已经证明AAV可以被设计成穿过数百微米的致密组织 - 充满细胞外基质网络,细胞体和过程 - 并且戏剧性地增加基因递送至远离非侵入性注射部位的重要靶细胞。这种能力可以基本上拓宽AAV治疗视网膜神经变性的治疗潜力。此外,需要通过其他复杂组织结构递送的基因治疗方法也可以受益于这种工程策略,包括全身给药时的内皮屏障(例如,血脑, - 视网膜,肌肉或肿瘤),或者组织内local delivery的肿瘤。选择病毒以穿透视网膜并感染治疗相关细胞的这种方法在先前的工作中取得进展,该工作在体外选择AAV文库或在体内选择病毒以在注入血流后一般定位于器官。
在正常小鼠视网膜和人类视网膜疾病模型中,新的AAV变体在无创施用于眼睛的玻璃体液后提供了治疗量的感光细胞和RPE的转导。 此外,非人灵长类动物中心凹的转导很强 - 这是一个对高视力视力至关重要的区域,在视网膜下注射 - 以及中央凹以外的许多区域 - 可能会因RPE脱离而受损。 非人类灵长类动物的未来工程可以实现更广泛的泛视网膜表达。
创建一种新的AAV变体,成功转导玻璃体内的所有视网膜层,为广泛的其他遗传性视网膜退行性疾病提供治疗潜力。 7m8的泛视网膜感染特性,与启动子或microRNA靶区域相结合,介导细胞限制性表达,使其成为靶向视网膜中其他神经元亚群的有价值载体。 例如,工程化光敏通道(例如LiGluR或其他光遗传学工具,包括通道视紫红质变体)的7m8基因递送至ON双极细胞或视锥光感受器内部区段可允许在视网膜变性的晚期人工恢复光敏感性。。
7m8的视网膜转导效率与其血清型AAV2相比可能是由于该变体的肝素亲和力降低,这可能会降低ILM中的衣壳形成,并增强穿透视网膜层的渗透性。 此外,肽序列可赋予与新细胞表面受体的结合或增强细胞内病毒运输。 在任何情况下,与之前的载体相比,7m8衣壳的高感染性可以使得使用相对低的剂量,从而降低对载体衣壳蛋白的免疫应答的机会,这是玻璃体内递送的AAV载体的重要考虑因素。
四、方法和材料
4.1 文库生成和病毒式制作
为了在AAV2 cap基因上产生Y444F突变,以及所有随后的酪氨酸 - 苯丙氨酸突变,我们使用了一个定点诱变试剂盒(QuikChange Lightning,Agilent Technologies)。 正如我们先前报道的,如所描述的,通过使得到的AAV2 Y444F帽经历易错PCR而产生随机诱变文库。 正如我们所报道的那样,7mer肽展示文库,基本上如前所述创建,以及通过DNA改组来自AAV1,2,4,5,6,8和9的cap基因构建的AAV文库,(也被使用。 如前所述包装在CAG或Rho启动子下表达GFP的rcAAV文库和rAAV载体,并通过定量PCR获得抗脱氧核糖核酸酶基因组滴度。
。。。
参考资料
-
- In Vivo–Directed Evolution of a New Adeno-Associated Virus for Therapeutic Outer Retinal Gene Delivery from the Vitreous
