【6.6.1】通过基于结构的计算机辅助蛋白质设计来建模和缓解高浓度抗体的粘度
sam点评:
这是2020年5月份刚发表,通过计算预测并设计突变减轻抗体粘度。里面有很多经验,可以直接借鉴。
- 一共设计了2轮(因为第一轮结果不好),最终设计序列的黏度降低了2倍以上。
- 突变位置:设计突变的区域不仅仅是FR区域,还包括CDR
- 设计思路:降低负电荷的patch以及疏水性区域
- 具体策略: 1)基于结构预测亲和力成熟,整个设计不能影响亲和力; 2)interface区域尽量不要变; 3)抗体库中高频正电荷残基,用来突变序列中负电荷残基 4)突变以后,用Sharma(2014,MOE中用到的方法) ,SCM(2016年),Tomar(2017年)三个方法来预测黏度是否会变化。 这三个方法不是特别靠谱,假阳性的突变比较多,需要谨慎。
为了使抗体成为成功的治疗剂,许多竞争因素都需要优化,包括结合亲和力,生物物理特性和免疫原性风险。需要以高浓度(> 150 mg / ml)配制抗体以实现合理体积(理想地<1.0 mL)的皮下给药可能会产生其他限制。不幸的是,高浓度的抗体可能表现出高粘度,这在递送时施加了不切实际的限制(例如多次注射或大的针头直径)并阻碍了有效的生产。在这里,我们描述了抗PDGF-BB抗体的优化,以降低粘度,使配制的浓度从80 mg / ml增加到大于160 mg / ml,同时保持结合亲和力。我们进行了两轮结构导向的合理设计,以优化表面静电性能。对这一组的分析表明,净正电荷的变化和负电荷patch的破坏与粘度的降低有关,但其作用在很大程度上取决于局部表面环境。我们在这里的工作提供了全面的研究,探索了Fv和CDR区域电荷变化的广泛采样以及针对多个负电荷patch的目标。总的来说,我们对40种独特的抗体变异体进行了粘度测量,并获得了完整的序列信息,与以前报道的数据相比,该信息可提供更大,更完整的数据集。
一、前言
抗体作为治疗剂的使用正在增长,目前在美国和/或欧洲已批准了80多种。 [1]抗体是有吸引力的治疗方法,因为与血清中的小分子相比,它们对抗原的特异性更高,而且血清半衰期显着增加,并且通常具有良好的活性,例如效应子功能(effector functions)。 [2]但是,由于它们的生物物理特性和大尺寸,无法口服,给药主要限于静脉内和皮下(SC,subcutaneous )注射。 [3]在许多临床和商业场合,由于患者易于使用,后者通常是首选,但每次注射的体积限制为1至2mL。 [4-6]当需要大剂量时,体积限制要求高浓缩蛋白溶液的浓度高达150至180 mg / ml。在这些浓度下,与自身相互作用相关的生物物理特性(例如抗体的聚集,溶解度和粘度)可能是限制因素。为了成功地SC施用具有最佳可注射性和最小痛苦的抗体治疗剂,材料的优选粘度在所需浓度下低于20厘泊(cP,centipoise )。 [7]此外,在制造过程中通常需要高于预计剂量的浓度才能进行缓冲液交换和配制,而过高的粘度会导致过滤器堵塞和材料损失。 [6]
减轻高浓度粘度的策略包括优化配方,优化序列或筛选具有最佳性能的候选分子。 [8]
- 配方优化包括改变缓冲液,pH,盐浓度和赋形剂的使用。 [9-14]偏离标准平台条件通常需要开发专门针对每种抗体量身定制的其他分析方法和稳定性监控,从而导致程序延迟和周期时间延长。
- 原则上,序列优化可以帮助鉴定平台配制条件下具有改进的粘度曲线的变体,尽管已证明许多此类降低粘度的实例均不利于亲和力或活性。 [15-18]
合理优化抗体需要了解并具有预测结构/功能关系的能力。
-
文献中的一些研究试图通过改变表面电荷和疏水性来解决粘度。通过电荷变化突变实现了粘度的小幅度降低(<2倍),而活性没有太大损失。 Nichols等通过去除带负电荷的残基,在103 mg / ml mAb浓度下将粘度从16.9 cP降低到13.2 cP,[17]而Chow等人还显示了通过电荷变化,在130 mg / ml mAb浓度下从15 cP到〜8 cP的粘度略有降低。 [15] Geoghegan等人报道了更大的粘度降低(> 4倍)。和Yadev等使用电荷变化突变或互补决定区(CDR)交换。然而,在前一种情况下,这种改善与亲和力的大量损失有关(12至200倍)[16],而在后一种情况下,进行CDR交换时并未考虑抗体的活性,这大概不会考虑到剧烈的序列变化,可以保持这种状态。 [18]这些研究中包含的小数据集(4-7个变体)也使得很难得出推广这些优化方法的真正潜力。
-
还已经报道了利用电荷和疏水特征来生成抗体粘度的预测模型的尝试。 Sharma等研究了FV电荷,-电荷不对称性和-疏水性与多种抗体粘度之间的关系。在此,粘度的增加与净负电荷和电荷不对称性的增加密切相关,并且在较小程度上与疏水指数的增加相关。 [20] Agrawal等产生了一种预测工具(空间电荷图(SCM)),该工具证明了FV域中的负静电斑块的程度和大小与几种临床抗体的粘度之间的相关性。 [19]同样,Tomar等人训练了支持向量机(SVM)工具来预测几种抗体的粘度曲线。在这里,他们发现FV电荷与疏水性在预测粘度变化中起着重要作用。 [21]
综上所述,先前的研究表明,一般而言,静电和较小程度的疏水性在抗体的粘度中起作用。抗体的pI通常为8–9,因此在pH 4.5至7.5的典型制剂缓冲液中,它们具有净正电荷。 [22,23]此外,大多数恒定域在这些缓冲条件下具有正净电荷。 [24]在长距离时,这将是排斥性的,但在电荷分布不均匀的情况下,负电荷斑块的相互作用可显示出对其余抗体的总体吸引力,并导致自缔合。 [18] CDR或可变区中负电荷的浓度可能导致与抗体中其他正片(包括恒定区)的自缔合,从而导致粘度增加。 [8、20、24]
我们在此提出的工作旨在将这些通用原理应用于高粘度抗PDGF-BB(血小板衍生生长因子B同型二聚体)抗体的优化,同时保持其结合亲和力和总体良好的developability 。抗PDGF-BB抗体在98.8 mg / ml时测得的粘度为40 cP,在150 mg / ml时的外推值为250–300 cP。我们的目标是在高浓度(> 150 mg / ml)下将粘度降低至小于20 cP。我们应用了两轮基于结构的设计来调节粘度,同时保持稳定性和结合亲和力。最终得到的优化lead可在1至2 mL SC注射液中输送150至300mg药物产品。在这些设计中,我们集中于将减少可变区,CDR和负电荷斑块内净负电荷的突变。通过对大量突变进行采样,可以提高我们对控制粘度与其他关键属性(如亲和力和稳定性)的参数的了解。我们的结果表明,谨慎使用基于结构的设计可以避免先前在尝试修复粘度时报道的亲和力/稳定性损失。用本文报道的全序列信息产生了40种独特抗体变体的粘度测量值。大量的数据为更广泛的科学界提供了更多资源,以进一步增进我们对抗体粘度和生物治疗设计中其他重要属性的理解和建模。
二、结果
2.1 减粘突变设计 Design of viscosity reducing mutations
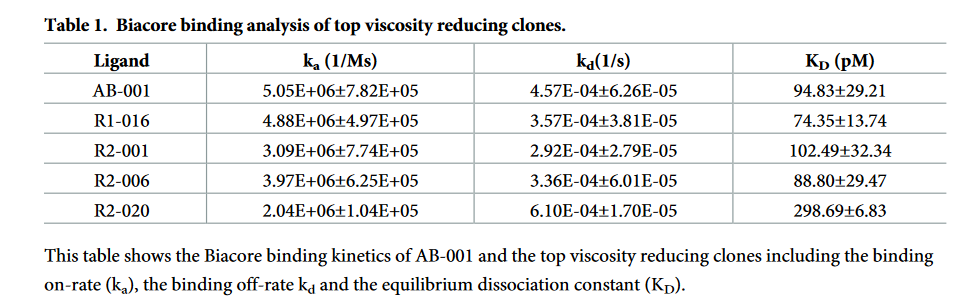
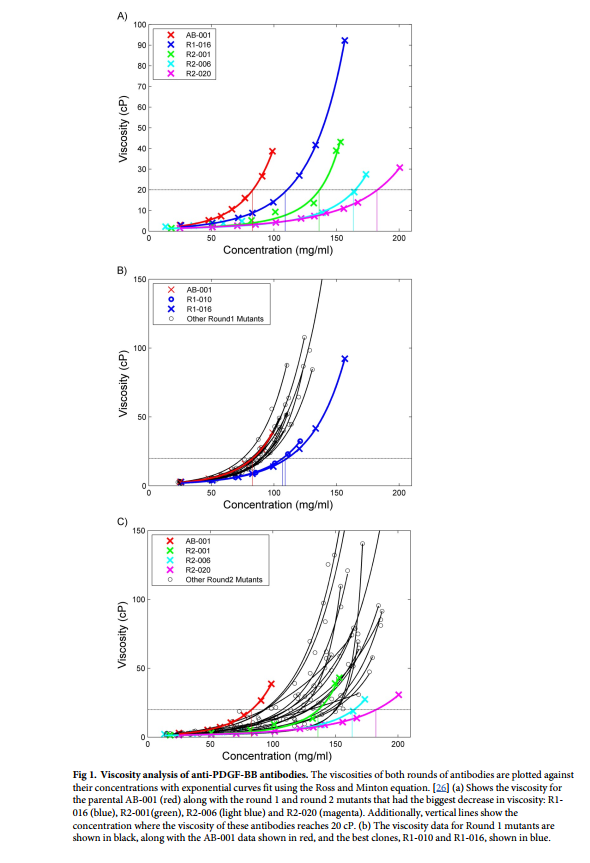
血小板衍生生长因子B(PDGF-B)是一种二聚体生长因子,其活化作用驱动细胞外基质的增殖,迁移和产生,其信号传导与纤维化有关。 [25]我们先前已经开发了一种潜在的生物治疗性抗PDGF-BB抗体(AB-001),其结合特性非常好,与PDGF-BB的亲和力为94.8 pM(表1)。此外,该抗体的大多数生物物理特性(如稳定性和聚集倾向)都是可以接受的(表2)。但是,AB-001的粘度明显高于所需的粘度。由锥板流变仪确定,AB-001的粘度在〜83 mg / ml时超过20 cP(图1A)。这远低于> 150 mg / ml的所需制剂浓度,将需要多次SC注射才能达到该递送量。最初对添加的盐进行配方筛选并未显示出粘度的显着降低(S1图),这使我们发起了一系列基于结构的序列优化,旨在将粘度降低至理想范围(在> 150 mg / ml时低于20 cP) ),而不会显着影响活性或其他生物物理特性。
在以前的工作中,我们解决了以2.3Å的分辨率与PDGF-BB结合的AB-001变体的晶体结构(PDB ID:4QCI)。 [27]该抗体的可变区与AB-001的同源性为97%,在轻链(LC)中仅包含5个构架差异,在重链(HC)中仅包含2个构架差异(S1表)。这使我们能够生成与PDGF-BB结合的高质量AB-001同源性模型,从而不仅可以详细了解抗体的界面,还可以了解抗体的表面特性。
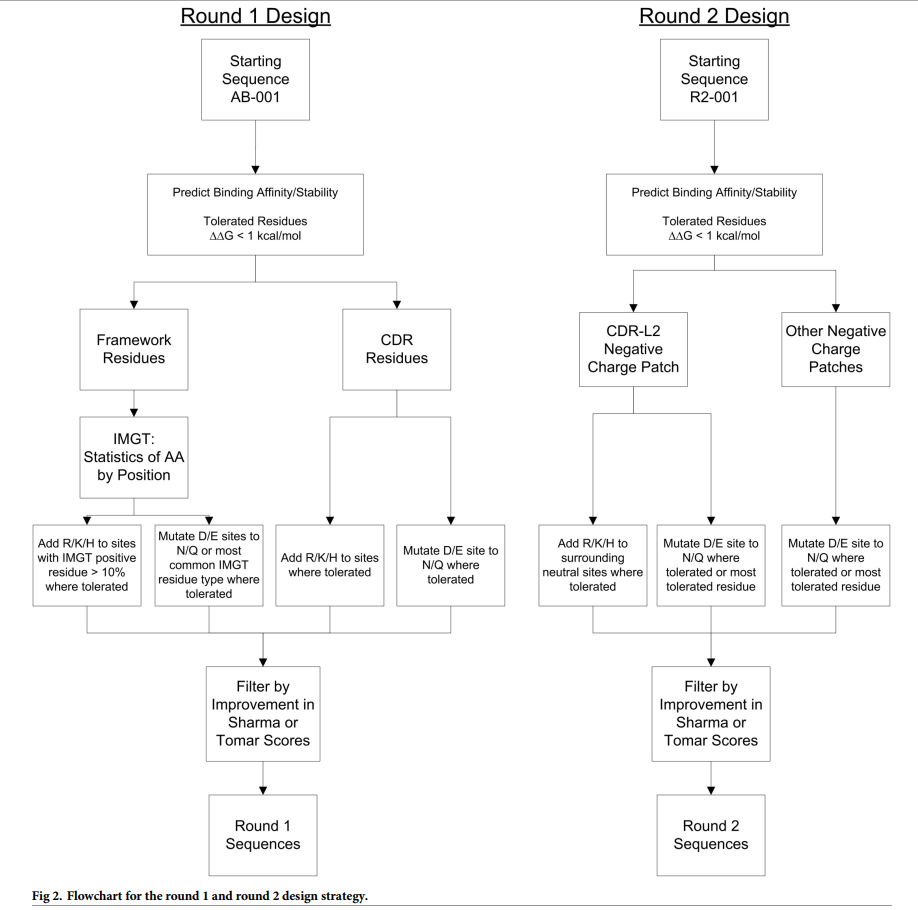
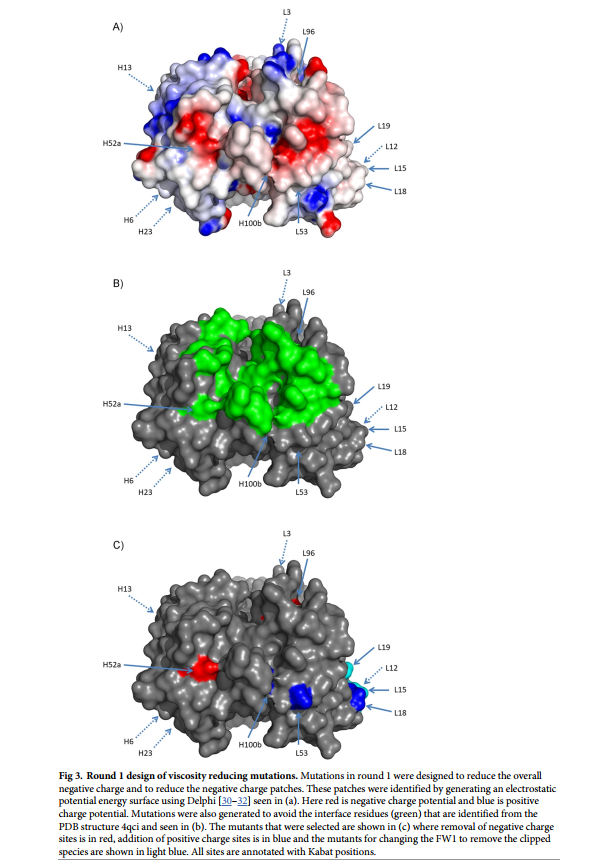
识别降低粘度的突变(第1轮)的最初设计重点在于修改了AB-001电荷模式的突变,特别是减少了负电荷或负电荷斑块的数量。以前的工作已将这些类型的电荷变化确定为在粘度中起重要作用。 [18,28,29]实施了其他设计约束条件,以维持分子中的结合亲和力和其他重要的可开发性参数,包括稳定性,溶解性和免疫原性。为了解决这个问题,我们应用了以下设计策略(图2中的第1轮)来识别会引起净正电荷变化(添加正电荷残基或去除负电荷残基),预测保持亲和力和稳定性的突变,并且仅限于常见人类序列中存在的CDR中的位点或框架中的突变(S2表)。该方法的详细步骤是
- 对于每个位点,使用带有AB-001:PDGF-BB复合物的Discovery Studio 3.5计算突变后的稳定性变化和突变后的结合亲和力变化。从这些计算中,确定了一组突变,这些突变被预测增加了净电荷,同时又不影响稳定性或结合亲和力(耐受的突变被预测为ΔΔG<1.0 kcal / mol)。
- 在可容忍的情况下,CDR区中的Glu和Asp位点进一步分别限于Gln或Asn的突变。
- 如果耐受,允许CDR区中的中性位点突变为Arg,Lys或His。
- 然后将框架突变限制为在人抗体序列或具有高可能性的野生型Glu或Asp的位点中具有高可能性(> 10%)阳性残基(Lys或Arg)的突变( > 10%)的另一个中性或阳性残基。
- 对于满足这些条件的所有可能的突变,我们然后使用两种不同的公开方法预测粘度来表征突变。
- 一种是在Sharma等人中描述的基于序列的方法。 (称为Sharma方法),该方法根据序列基于Fv电荷,VH / VL电荷相似性和疏水指数来预测粘度。 [20]
- 第二种是类似的方法(Tomar方法),该方法使用该结构来计算VH,VL和铰链电荷以及疏水性表面积,以预测浓度依赖性粘度。 [21]
- 对于Tomar或Sharma方法,所有允许的突变值均降低。
- 从这里选择一组优先设计,其中包括与CDR中负电荷补丁非常接近的突变,这是通过使用Poisson Boltzmann计算器DelPhi [30-32]计算静电表面电势图确定的和构架突变,其中包括一个双突变体,其总片段或周围残基在人类种系中被发现。所有VH突变体还包括K94R突变体,以消除任何潜在的糖化风险。
- 最后,还选择了重链和轻链突变的组合。进行这些操作是因为对先前报告的将电荷与粘度进行比较的数据的分析[8、20、21、24、29]表明,可能需要将电荷改变两次或更多次才能将粘度降低至所需水平。这套17个Round 1突变体(R1-002至R1-018)在图3和表3中显示,序列在S1表中。

2.2 生物物理表征 Biophysical characterization
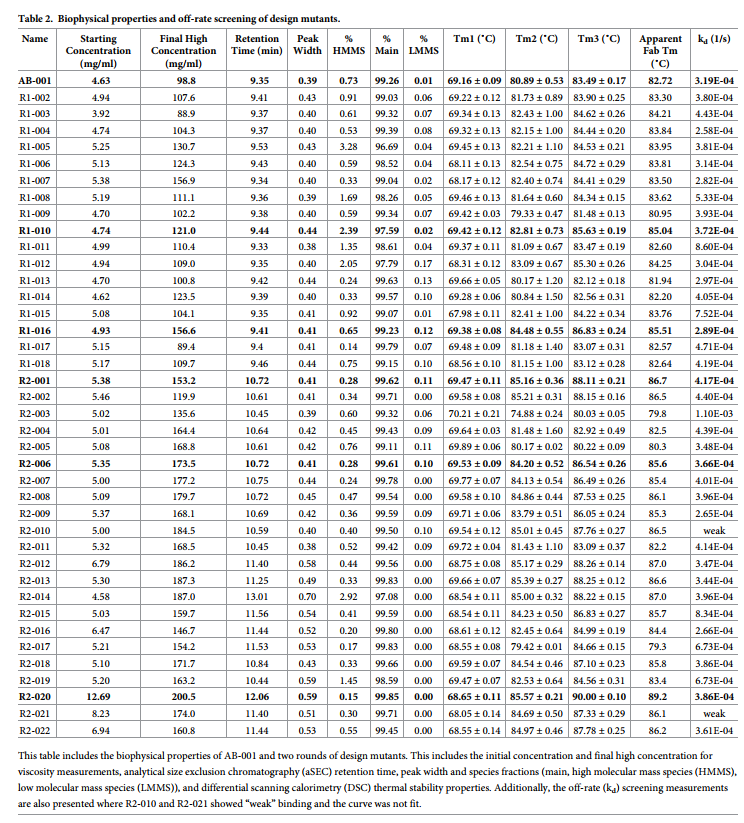
使用分析尺寸排阻色谱法(aSEC)评估AB-001和第一轮设计抗体的聚集状态。 PBS中含有精氨酸的改良流动相可用于亲本和所有变体,以最大程度地减少蛋白质柱基质之间的相互作用。分析了各种浓度的抗体样品,以确认所有粘度突变体均包含<5%的聚集体,并从aSEC柱中回收了良好的蛋白质(表2)。进行差示扫描量热法(DSC),以确定通过热容变化监测的粘度突变体的热稳定性,该变化是温度的函数,其中Tm被定义为展开转变的中点。与亲本分子AB-001的比较用于确保突变不会不利地改变这些突变体的整体稳定性。所有突变体均被认为在65°C以上的第一个展开转变Tm1稳定,并且具有可比的DSC谱(表2)。与亲本克隆相比,克隆R1-010和R1-016显示出更高的表观Fab热稳定性。
2.3 粘度测量
使用Anton Paar流变仪为亲本AB-001和第1轮设计的突变体生成粘度曲线。将粘度数据(S3表)相对于蛋白质浓度(mg / ml)的各个范围作图,以生成每个突变体的粘度曲线(图1b)。除克隆R1-007和R1-016外,许多克隆在过滤单元中的浓缩程度很低,其中大多数无法达到> 100 mg / ml的浓度,并且尝试这样做会导致蛋白质大量损失。设计的粘度突变体的最终浓度列于表2。粘度数据符合指数Ross-Minton方程[26](请参见方法,方程2和3),以100 mg / ml的浓度内插/外推, 150 mg / ml,粘度达到20 cP的浓度(表3)。所有18种抗体的数据都很好地符合此方程,相关系数(R2)> 0.99(S2图)。除克隆R1-016和R1-010是在150 mg / ml时粘度降低3倍的唯一克隆外,大多数克隆的粘度曲线与亲本AB-001相似。粘度达到20 cP时浓度增加20%。这两个克隆在最大粘度阈值为20 cP时具有约109和107 mg / ml的较高蛋白质浓度,而在150 mg / ml时,其粘度降低至约73和99 cP(R1-016的内插和R1的外推-010)。
2.4 结合分析
对亲本抗体以及17个第1轮设计变体进行了Biacore不合格率分析。 所有18个克隆的关闭率(off-rate)非常相似,没有显着增加(表2)。 克隆R1-016显示出最大的粘度变化,因此我们进行了完整的动力学分析,以与亲本进行结合亲和力的比较。 克隆R1-016的平均结合亲和力为74.4pM,与94.8pM的亲本值相当(表1)。 这些突变的引入并没有显着改变结合亲和力。
2.5 进一步优化粘度
来自第一轮突变体的数据表明,在17种设计中,只有2种表现出了明显的粘度变化。它们是具有轻链突变N53K的克隆R1-010,以及具有相同轻链突变N53K的克隆R1-016,以及两个重链突变E6Q和Q13K。其余突变体中唯一重要的异常值是克隆R1-011(LC突变D96N),其粘度比亲本略高。所有突变均具有净正电荷变化,并通过Sharma评分和Tomar评分预测粘度降低。考虑到突变的位置似乎在降低粘度方面起着重要作用,因此设计了第二轮突变,以类似于N53K突变的方式增加电荷。
第二轮突变的设计基于R1-016,其显示出最大的粘度改善,而结合亲和力没有变化。但是,R1-016(和其他第一轮克隆)的大规模表达和纯化显示出大量的低分子量物质(〜10%)(图4) 被质谱确,认为位置Glu3之后的轻链截断。这是出乎意料的,代表了下游纯化工艺开发的重大复杂性。为了减轻这种剪裁,将FW1更改为另一种λ种系IGLV3-21 * 01。该克隆(R2-001)与其他3个突变(S13A,Q16K和S19R)一起使3位的Glu突变。这些框架突变将导致正电荷的净正电荷变化加3,并降低Tomar和Sharma得分,此外,LC突变S19R与关键的N53K突变非常接近,后者在第一轮中降低了粘度(图3) 。因此,期望这种新的框架变体维持或可能进一步降低抗体的粘度。
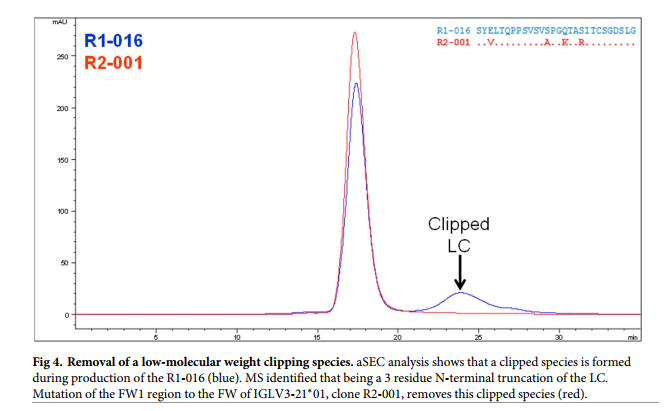
如前所述,表达,纯化和表征了该新克隆(R2-001)。这项新设计成功地完全消除了R1克隆系列的剪裁(图4),同时保持了其他生物物理特性(表2)和结合亲和力(表1)。此外,使用与第1轮相同的方法测量粘度,并显示出相对于克隆R1-016(图1a)的进一步改进,从而将150 mg / ml的粘度降低至约38 cP,并达到132 mg / ml的更高浓度在20 cP时(表3)。
根据降低粘度的LC突变N53K和FW变化突变的位置,使用图2所示的方法设计了一组新的克隆(第2轮)以进一步降低粘度。
- 与第一轮设计相似,对所有潜在突变进行了结合亲和力和稳定性的筛选(S2表)。
- 在N53K突变附近的CDR-L2负电荷补丁周围产生了一组正电荷引入突变。
- 此外,鉴于电荷贴剂(patch)可能对粘度有重要意义,还引入了其他负电荷去除突变。这包括LC中的负电荷补丁(包含L50和L51位),以及HC链中的其他负电荷补丁(包含H52a和H53位)(见图5a)。与正电荷变化突变不同,其中一些是结合界面的一部分,预计对结合亲和力的影响很小(预测的ΔΔG为1至2 kcal / mol,S2表)。这组21次第二轮突变(R2-002至R2-022)和参考R2-001在表3和图5中显示,序列在S1表中。表达并纯化了这22个突变体,并与第1轮相同地进行了生物物理表征。所有克隆均显示低于5%的高分子量物种(HMMS),并且在Tm1> 65°C时均保持可接受的热稳定性(表2) )。突变体R2-002和R2-003都在浓缩过程中形成沉淀并被丢弃。(这种突变思路会产生新的沉淀?)

对于第二轮设计突变体,以与第一轮设计(图1c)相同的方式生成粘度曲线,数据在S3表中。这些曲线使用如上所述的Ross-Minton方程(相关系数(R2)> 0.96)拟合得很好,并且在100 mg / ml,150 mg / ml的粘度和达到20 cP的浓度下显示表3。两个突变体显示粘度显着降低,在150 mg / ml时粘度降低了3倍,在粘度达到20 cP时浓度增加了20%。它们是具有LC突变S52K的R2-006和具有轻链突变D51N的R2-020。这些突变改善了粘度分布并增加了它们达到最大粘度阈值20 cP的浓度。从R2-001的〜132 mg / ml增加到R2-006的〜163 mg / ml和克隆R2-020的〜182 mg / ml。所有其他突变体的粘度与起始克隆R2-001相似或增加(图1c)。与亲本克隆AB-001在150 mg / ml时外推粘度> 450 cP相比,克隆R2-006和R2-020在150 mg / ml相同浓度下的粘度分别为12.6 cP和10.0 cP (图1a和表3)。
与第一轮设计中所见的那些克隆相似,筛选第二轮突变中的抗体的失效率(表2)。克隆R2-011和R2-021显示弱结合,克隆R2-004,R2-019和R2-022显示低RMax值。其余的克隆具有与亲本克隆相似的解离速率。对于那些降低粘度的克隆R2-001,R2-006和R2-020(表1)进行了另外的动力学分析。 R2-001(KD = 88.8 pM)和R2-006(KD = 102.9 pM)与亲本AB-001(KD = 94.8 pM)具有相似的结合亲和力。与其他克隆相比,R2-020(KD = 298.7 pM)的结合亲和力降低了约3倍。这与使用计算亲和力预测方法预测的结果一致,因为预测了R2-020的D51N突变在结合界面中起重要作用。
2.6 非特异性分析 Non-specificity analysis
第1轮和第2轮降低粘度的突变体均具有正的净电荷变化,R1-016为+ 3,R2-001为+ 6,R2-006和R2-020为+7。过量的正电荷与不良的生物物理性质,非特异性和不良的清除率有关。 [20,33,34] Sharma等。证明了0至6的最佳Fv电荷与清除性能差的风险降低相关。 [20]亲本AB-001和R1-016具有-2.01的低Fv电荷,而优化的突变体均具有最佳范围内的Fv电荷,R2-016为0.93,R2-001为3.87,R2-006为4.87, R2-020为4.85(表4)。 Rabia等分析了137种临床抗体,并证明了pH 7.4时预测的CDR净正电荷与包括非特异性和自缔合在内的不良生物物理特性之间的相关性。 [33]他们显示,在一系列非特异性分析中,净CDR电荷> 0表示红色标记的数量增加。所有这组突变体的净CDR电荷均小于0。亲本AB-001的净CDR电荷为-3.7,而R1-016为-2.7,R2-001为-2.7,R2-006为-1.7和R2-020为-1.7(表4)。
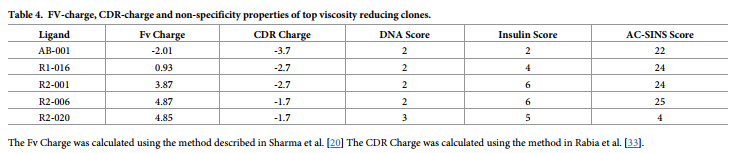
为了进一步验证添加这些正电荷的效果,我们对第一轮和第二轮电荷突变体进行了两种非特异性测定(DNA结合ELISA和胰岛素结合ELISA)以及自缔合测定(AC-SINS,self-association assay ) (表4)。 先前已经证明,这些测定的倍数中的高值(> = 11)与PK研究中的不良清除率相关。 [35]在DNA和胰岛素分析中,没有一种抗体具有很高的价值。 AB-001在自缔合AC-SINS分析中具有很高的价值。 其他突变体均未显示AC-SINS分数增加,而R2-020显示出显着降低。 这些测定表明,这些突变体的总体非特异性不会增加,或者在R2-020的情况下可能会降低。
2.7 降低粘度的突变分析
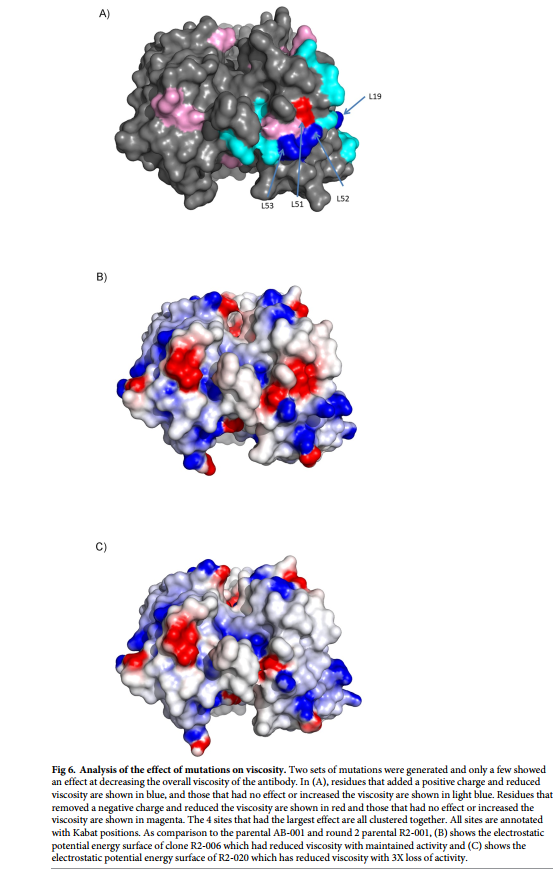
两轮设计基于以下假设:负电荷的减少和/或负电荷斑的减少将导致较低的粘度变化。在这些设计中,粘度的最显着变化(150 mg / ml时粘度下降3倍,浓度在20 cP时浓度增加20%)与LC突变N53K,S52K,D51N和FW1与IGLV3-21的变化有关* 01种系,包括在空间上与LC位置53、52和51紧密相邻的S19R。许多其他突变体的电荷变化相似,但没有HC突变(E6Q,Q13K,A23R,D52aN,Q105R,D52aK, D53Q,D61N,Y97H,Q100bK,D101N,D101Y)或其他LC突变(E3V,T18R,D96N,S27K,H34K,Y49H,Y49R,S65K,S67K,G68K和D96K)显示出粘度的显着变化。所有成功的降粘突变均具有净正电荷变化,但有许多相似的电荷变化对粘度没有影响或具有负面影响。大多数有效的突变都集中在LC中的负电荷斑块上,而影响最大的突变则位于CDR-L2中部附近的一小部分(图6a)。在亲本克隆(图3a)和优化克隆R2-006(图6b)和R2-020(图6c)的静电表面之间的差异中可以看出这些突变对该负电荷补丁的接近性和影响。 。
在所进行的设计中,第一轮只有2个,第二轮只有2个产生了粘度的大幅降低。第一轮和第二轮的设计具有相似的净负电荷减少量,并通过Sharma和Tomar评分方法预测了变化,先前已证明这与粘度降低有关。 [20,21]因此,成功率如此之低令人有些惊讶。因此,我们进一步检查了粘度与SCM所预测的电荷,Fv-电荷和表面电荷斑块的变化之间的关系,并将其与设计中使用的两种预测方法(Sharma评分和Tomar评分)进行了比较(表3)。 SCM是一种使用抗体结构识别表面电荷和电荷簇的不对称性的方法。 [19]当将Fv-Charge或SCM评分与抗体粘度为20 cP的浓度进行比较时,总体相关系数(R)分别为0.71和-0.70,这与Sharma评分的预测性能相似( R = 0.72)和Tomar得分(R = 0.70)(图7)。但是,仔细检查后发现,这些方法的许多显着相关性与区分第一轮和第二轮突变体的能力有关。 R2-001的粘度显着降低,电荷变化也为+4,并且SCM,Tomar和Sharma得分降低(与AB-001相比),是所有第2回合变体设计的中心,从而扭曲了数据集的整体组成。
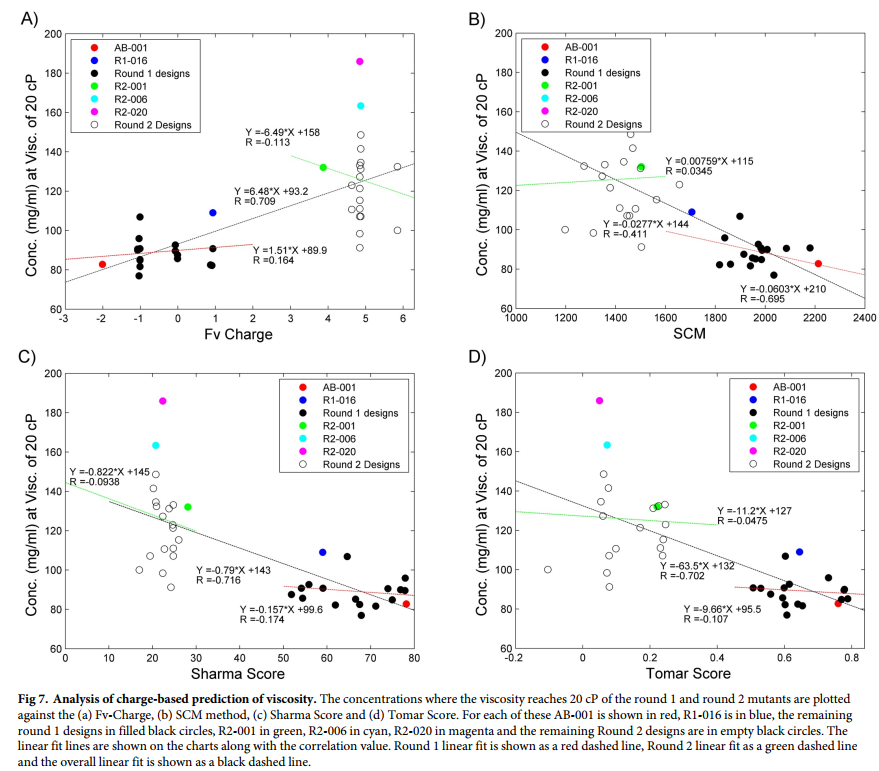
作为一项额外的测试,我们确定了这些方法在第一轮和第二轮设计中区分单个突变体的能力。当查看第一轮设计的相关性时,Fv电荷的相关性(R)降低到0.16,SCM降低到-0.41,Sharma得分降低到0.17,Tomar得分降低到0.10。尽管相关性较差,但SCM方法确实能确定出降低粘度最高的克隆(R1-016),并在前5位具有次佳的克隆(R1-010)。这很可能是由于SCM得分可以识别出降低粘度的克隆。与粘度降低相关的结构集中的电荷区域,而FV电荷,Sharma评分和Tomar评分均以相似的方式查看电荷突变,无论VH或VL中的位置如何。对第二轮突变进行了相同的分析,其中Fv-电荷的相关系数R为-0.13,SCM方法为0.03,Sharma评分为0.09,Tomar评分为0.05。在这里,所有方法的相关性都很弱,无法分离粘度显着降低的两个突变体。尽管事实表明,这些类型的预测之间更强的相关性适用于完全不同的抗体组,[19-21]在这种情况下,在这种情况下,它们在由序列相关的抗体变体组成的集合中表现不佳,而这些变体具有相似的电荷性质变化
四、讨论
为了达到有效剂量或实际给药间隔,可能需要以高浓度递送抗体。粘度限制了浓缩许多抗体的能力。 [8、20、21、24、29]减轻高粘度是困难的,因为在许多情况下,负责高粘度的残基可能位于抗体的互补位内。 [15-18]对于具有高结合亲和力的抗体,这尤其具有挑战性。在这里,我们使用结构指导设计来引入序列变体并降低高亲和力但高粘度抗PDGF-BB抗体AB-001的粘度。抗体变体R2-006达到20 cP最大粘度阈值的浓度从80 mg / ml(对于AB-001)增加到超过160 mg / ml,有效地将可传递剂量加倍,而对活性没有任何影响或不改变配方。其他变体R2-020可以将其进一步扩展至185 mg / ml,尽管结合亲和力会适度降低3倍(从94.8 pM降至298.7 pM)。在设计的39个变体中,大多数以缓慢的离体率(off-rates)保持结合,与亲本没有区别。 X射线共晶体结构复合物的可用性使我们能够仔细选择预计在结合互补位之外的突变。鉴于能够降低粘度并保持亲和力的突变成功率低,这是该方法的关键组成部分,可以减少需要搜索的总空间。先前的工作表明,关键残基/ CDR环可以突变,从而对粘度产生重大影响。在每种情况下,设计仅依赖于FAB的同源性模型或晶体结构,而无法考虑对结合重要的残基。 [15-18]这是治疗剂设计/优化的主要限制,因为可能影响CDR粘度的突变也可能对活性产生重大影响。在这里,我们能够在不同的框架中利用PDGF-BB的共晶体结构与相关版本的AB-001的共晶体结构在两者之间取得平衡,并在实现目标的同时保持分子的活性和其他生物物理特性这些降低粘度的相同目标,表明可以通过使用相关的共晶体结构与同源性建模相结合来实现治疗设计中更高的精确度。
鉴定出几种允许降低粘度的突变,但是大多数突变对分子的整体粘度没有影响。此外,许多无效的突变与有效的突变非常相似。每个总电荷都有净增加,其中许多都针对负电荷斑块,有些甚至是在负电荷斑块内进行突变的。一些突变改变粘度的事实表明电荷的确在粘度的自缔合中起着重要作用,但是相似突变的变化作用表明这个问题还有很多。我们在这里的工作提供了最全面的研究,探讨了Fv和CDR区域电荷变化的广泛采样以及针对多个负电荷斑块的情况。这导致识别出驱动高粘度的电荷斑块的某些“热点”,而附近的相似电荷斑块在粘度方面的作用则微乎其微或相反。该结果最初在第一轮研究中令人惊讶,这引起了人们对N53K LC突变某种程度上是一个异常的担忧。但是,LC位点N53附近的R2中的其他变体,提供了对该特定电荷补丁相对于Fv中其他电荷补丁和区域的重要性的进一步确认。这些结果表明,电荷补丁的精确三维排列和正电荷排斥性突变在抗体的自缔合中起重要作用。这种类型的基于电荷的粘度“热点”是否可以与其他粘性抗体一起推广还有待观察。
先前的工作表明,电荷模式和不对称性(charge patterns and asymmetry)在粘度变化中起重要作用。 [18–20]在这里我们可以看到电荷的这种不对称性可以归结为各个残基的水平。仅使用domain level电荷变化进行预测的模型不够细微,无法区分此处看到的粘度变化。这可以通过比较SCM分数与Fv charge,Sharma分数和Tomar分数来举例说明。在这里,第一轮突变在可变域或VH和VL域的电荷变化方面有许多相似之处,因此不足为奇的是,只有SCM方法才能区分靶向LC电荷斑的成功突变体,而不是整个Fv。但是,在R2设计中,甚至这种方法也很短,因为围绕剩余LC电荷补丁的许多这些突变基于SCM得分具有相似的作用,但似乎对抗体的自缔合和粘度具有非常不同的影响。考虑到抗体电荷分布的差异以及该抗体的其他部分与抗体其他部分的未知性质,这种推测的LC电荷补丁将使抗体突变体效应的预测成为一个颇具挑战性的问题。这表明这种局部电荷变化变异的预测,无法通过仅使用仅捕获粘性和非粘性抗体之间的大量电荷差异的描述符进行训练的方法来充分解决。这种类型的训练可能会采用此处描述的系统突变数据类型,但要在几种不同的抗体系统的背景下进行。除了需要更多数据外,可能探索的方法的改进还包括:
- 使用原子级而非域级或残基级计算进行更细粒度的建模;
- 对电荷的空间方向(包括偶极子和静电势能表面图)进行更好的描述
- 以及预测整个抗体中的自缔合和互补性(self-association and complementarity)。
为了优化治疗先导,将需要开发这些类型的更高级的方法。
五、方法
5.1结构建模
人IgG1抗体AB-001的Fab区的同源性模型(VH = EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSYISDDGSLKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKHPYWYGGQLDLWGQGTLVTVSS,VL = SYELTQPPSVSVSPGQTASITCSGDSLGSYFVHWYQQKPGQSPVLVIYDDSNRPSGIPERFSGSNSGNTATLTISGTQAMDEADYYCSAFTHNSDVFGGGTKLTVL,CH1 = IGHG1 * 01和CL = IGLC2 * 01),使用从Discovery Studio 3.5建模器包和PDB晶体生成将4QCI作为模板。 [27]该结构包含与PDGF-BB结合的AB-001的紧密同源物(相同的CDR残基,具有很少的框架突变)。对于此结构,电荷分配是使用Discovery Studio 3.5(Accelrys Inc.)的“Calculate Protein Ionization and Residue pK”软件包生成的。为了准备用于稳定性和亲和力计算的结构,通过将Discovery Studio 3.5的“准备蛋白质”协议应用于具有默认参数和CHARMPLR力场的稳定性和绑定亲和力输入结构,来构建dsv格式化的结构。
通过将Discovery Studio 3.5中的“Calculate Mutation Energy (Binding))”协议应用于dsv格式的结构,可以计算出突变后的结合亲和力的变化。使用的默认参数为力场(CHARMm极性),内部介电常数(10),溶剂介电常数(80),静电缩放因子(0.5),VDW缩放因子(0.5)和熵缩放因子(0.8),以及非极性表面系数设置为0.007。配体定义为两条PDGF-B链。通过将Discovery Studio 3.5中的“计算突变能量(稳定性)”协议应用于dsv格式的Fab结构,可以计算出突变后的稳定性变化。使用的默认参数为力场(CHARMm极性),内部介电常数(10),溶剂介电常数(80),静电缩放系数(0.5),VDW缩放系数(0.5)和熵缩放系数(0.8),非极性表面系数设置为0.007。
通过使用Poison Boltzmann程序DelPhi [30–32]计算静电势表面来识别电荷斑,该程序是Discovery Studio 3.5协议“带聚焦的静电计算”的一部分。 该计算的参数包括每轴65个网格点,50%的粗网格被溶质填充,90%的细网格被溶质填充,0.145 M盐浓度,80的溶剂电介质,2的溶质介电常数,溶剂探针半径 为1.4Å,离子排斥半径为2.0Å。 然后使用Pymol [36]将静电表面可视化,方法是将DelPhi网格文件加载到emap中,并用设置为-7(红色)至7(蓝色)的静电水平范围着色表面。
5.2 电荷突变统计
从PDB和IMGT [37-44]中发现的人类抗体序列集中,评估了所有Kabat位置的氨基酸类型分布。 然后,按人抗体序列中具有高可能且带正电的残基(Lys或Arg)(> 10%),或具有高可能性存在其他中性或带电残基的野生型Glu或Asp的位点进行分类 (> 10%)。
5.3 计算粘度预测
基于序列和结构信息,使用了三种方法来预测抗体的粘度。 Sharma方法是按照Sharma等人(美国国家科学院院刊)中描述的方案实施的。 根据公式1计算粘度,其中粘度(η)与Fv的净电荷(q),电荷不对称性(qsym)和疏水指数(HI)有关。 [20]
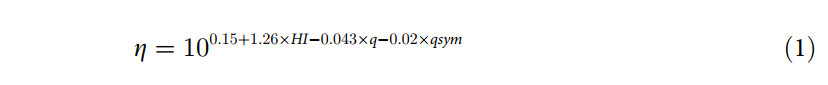
简而言之,通过将Asp,Glu,His,Lys和Arg残基的预测电荷相加,计算出pH 5.5时VH和VL序列的净电荷,其电荷由Henderson-Hasselbach方程定义,其pKa值来自Berg等人 [45]:Asp(3.9),Glu(4.3),His(6.0),Lys 10.8和Arg(12.5)。 VH和VL的总和为净电荷。电荷不对称性(qsym)计算为VH和VL净电荷的乘积。最后,基于每个氨基酸的艾森伯格标度(Eisenberg scale),将疏水性残基的总疏水性除以亲水性残基的疏水性总和之比,计算出疏水指数(HI,Hydrophobic index)。 [46]这里的疏水残基和评分为:Ala(0.62),Cys(0.29),Phe(1.19),Gly(0.48),Ile(1.38),Leu(1.06),Met(0.64),Pro(0.12) ,Val(1.08),Trp(0.81)和Tyr(0.26),亲水性残基和得分为:Asp(-0.90),Glu(-0.74),His(-0.40),Lys(-1.50),Asn (-0.78),Gln(-0.85),Arg(-2.53),Ser(-0.18)和Thr(-0.05)。
Tomar方法是通过遵循Tomar等人描述的协议来实现的。 [21]简言之,使用分子建模软件包Moe [47]中的蛋白质建模工具,使用Fv模板,使用电荷突变体的同源模型,通过蛋白质建模工具生成全长IgG的同源模型,以及使用PDB结构1HZH的完整IgG1模板。这些模型被质子化为5.8,盐浓度为10 mM。 VH电荷,VL电荷,铰链电荷和疏水性溶剂可及的表面积均通过Moe“蛋白质特性”模块[47]进行计算,其中pH设置为5.8,盐浓度为10mM。使用这些计算值,我们可以使用Tomar等人的公式1。 [21]计算值B,该值用于预测电荷突变体的相对粘度。
SCM方法是使用Agrawal等人描述的协议实现的。 SCM协议(版本3.1.2013)从作者那里获得,并使用电荷突变抗体和组氨酸残基设置为中性HSD残基的FV区的同源性模型与VMD(版本1.9.1)一起执行。
5.4 蛋白质生产 Protein production
Clarified conditioned transient HEK293培养基上样至蛋白A亲和柱(MabSelect SuRe,GE Healthcare Life Sciences)。蛋白A柱用50 mM Tris,150 mM NaCl,pH 7.5平衡。上样后,用平衡缓冲液洗涤色谱柱,然后再用2M精氨酸,50mM Tris pH 7.5和50mM Tris,0.5M CaCl2 pH 7.5洗涤。然后用10mM Tris,10mM NaCl pH 7.5洗涤该柱。然后用150 mM甘氨酸,pH 3.5逐步洗脱结合的蛋白质。用2 M Tris碱滴定至pH 7.5的蛋白A池,并过滤0.2μM。然后将滴定液上样到TMAE柱(EMD Milipore)上。平衡TMAE柱,并用50mM HEPES,65mM NaCl pH7.0洗涤。收集含有目的纯蛋白质的流通级分。将TMAE池与0.15M NaPO4、3.75M NaCl和3M尿素混合,然后装载到400ml Buty-S Sepharose 6 Fast Flow(GE Healthcare Life Sciences)上。用50mM NaPO 4,1.25M NaCl,1M尿素,pH 7.2(5-8CV)洗涤该柱。收集流出物,并用50mM NaPO 4,1M尿素,pH 7.2洗脱该柱。将HIC库与用10mM组氨酸,5%蔗糖,pH 6.0平衡的Sephadex G-25粗柱(GE Healthcare Life Sciences)进行缓冲液交换。过滤最终的混合物,使用30kDa MWCO设备浓缩至> 50 mg / ml。
5.5. Analytical size exclusion chromatography (aSEC)
5.6 Capillary differential scanning calorimetry (DSC)
5.7 Viscosity measurements
5.8 粘度参数拟合 Viscosity parameter fitting
为了使粘度数据适合所有浓度范围,我们使用了Ross和Minton方程(公式2)。 [26]
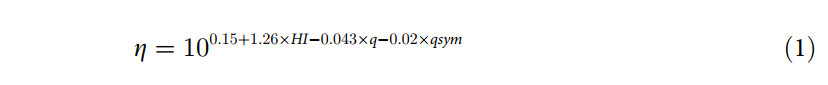
此处,η是粘度,η0是在零溶质浓度下溶液的粘度,[η]是特性粘度( intrinsic viscosity),c是抗体浓度,(k)是拥挤因子,(v)是形状确定因子。 我们对η0使用1.1 cP,并将[η]的值和比率(k / v)拟合为实验浓度依赖性粘度测量值。 该拟合是在Matlab(R2010b)中使用非线性最小二乘回归法nlinfit [48]完成的。 据此,我们能够内插或外推浓度为100 mg / ml和150 mg / ml的粘度。 我们可以使用Matlab(R2010b)函数nlpredci [48]计算此非线性最小二乘拟合的95%置信度。
方程2也可以重新排列以解决浓度(方程3),使我们能够适应抗体达到特定粘度的浓度。
 使用与之前相同的Matlab非线性最小二乘拟合函数,我们可以拟合粘度达到20 cP时的浓度,并且拟合该值时的95%置信区间。
使用与之前相同的Matlab非线性最小二乘拟合函数,我们可以拟合粘度达到20 cP时的浓度,并且拟合该值时的95%置信区间。
5.9 Biacore measurements
5.10 Non-specificity assays
参考资料
- PLoS One. 2020; 15(5): e0232713. Published online 2020 May 7. doi: 10.1371/journal.pone.0232713。Modeling and mitigation of high-concentration antibody viscosity through structure-based computer-aided protein design。 网址: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7205207/#pone.0232713.e002
