【3.9.2】桥接试验
在药物研发日益趋于全球化的背景下,药物的全球同步研发是一种共享资源的开发模型,在多个国家或区域的多个中心按照统一的临床试验方案、同期开展的临床试验。可以减少不必要的重复临床试验,缩短地区或国家间药品上市延迟,提高患者获得新药的可及性。这种全球同步研发,也称之为国际多中心临床试验。
传统的进口药物临床试验完全忽略了原地区的数据,仅仅依靠新地区的数据来证实药物在该地区的安全性和有效性。实际上就是在新地区重复原来的研究,浪费病例资源,也延缓了新药上市的时间。
本文将简要介绍一种基于原地区临床试验信息的临床试验,称之为桥接试验。
01 桥接试验定义
如果一个新药已经在原地区通过审批,要将其推广到新地区,可以利用原地区临床试验已有的信息,而按需在新地区进行小规模的附加试验研究,通过这些试验研究说明该药物对新地区人群是否具有同样的安全性、有效性、从而达到上市的目的。这类在新地区的附加试验称为桥接试验。桥接试验不能简单地理解为一种新的试验方法,而是药物临床试验和审批中的一种策略。
桥接试验不是一个单独的临床试验,而是一系列试验。根据实际需要,试验可能会包括药代动力学试验,Ⅰ、Ⅱ、Ⅲ期试验等内容。具体要进行何种试验,应该根据具体情况来决定,桥接试验的目的与传统试验也有不同,传统的临床试验可能是要达到差异有统计学意义,桥接试验只需要证明药物在新地区的安全性和有效性特征与原地区具有“相似性”。
02 桥接策略
原地域试验资料能否外推到新地域,以作为申请上市的依据,通常需要进行桥接试验,实施和运用的过程称为桥接策略。亚洲的桥接试验始于日本,纵览日本新药申请中成功使用桥接试验的药品,使用桥接策略可分四种模式:
一、以健康受试者为对象的,独立的PK研究和剂量-反应的临床试验;
二、以健康受试者和患者为对象的,独立的PK研究和Ⅱ期剂量-反应的临床试验;
三、不进行独立的PK研究,而在临床试验中包含PK研究;
四、进行独立的PK研究,而且在临床试验中也包含PK研究。
运用桥接策略,可以考虑在新地域用较少例数的患者进行PK对照研究或随机对照的临床试验,实现新地域和原地域临床资料的整合。对于药理学临床终点的桥接试验,通过评价新地域的PK数据与原地域的PK数据的相似性,可以确定针对新地域人群的相应剂量。但是仅凭不同种族之间的PK数据相似性,尚不能说明是否可以桥接。Ⅱ/Ⅲ期有效性随机对照临床试验, 通常也需要在新地域进行。
03 桥接试验中的统计方法
桥接试验必须建立在科学论证的基础上,在策划和评价桥接试验时,必须进行桥接试验评估。其目的是说明新地域进行的小规模试验与原地域的研究具有相似性,从而实现将原地域的临床数据外推到新地域的目的。基于ICH E5中的相似性,出现了一些桥接试验的评价方法。
① 桥接试验的必要性的评价
计算再现性或重现性概率,进行种族敏感性的度量,以划分桥接试验的类型。由下表可以看出,桥接试验的类型可以分为:无需进行桥接试验;仅仅使用药理学终点的研究;完全随机对照试验。具体来说,若药效学显示有地域差异,则有必要进行采用临床终点的随机对照试验。
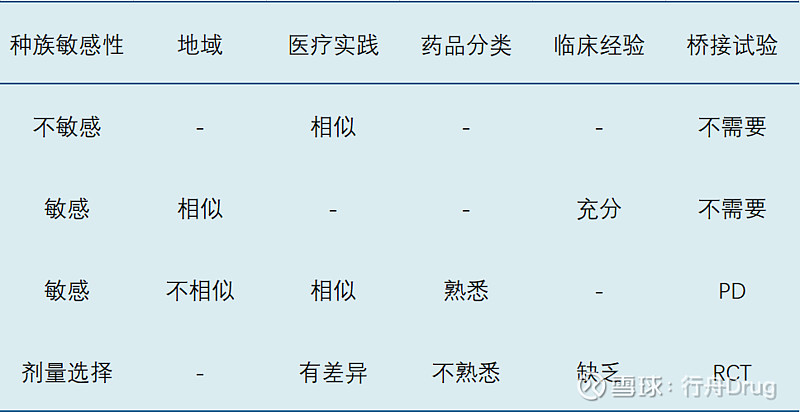
桥接试验分类–按照药品种族敏感性
② 相似性评价
以药理学终点为研究指标,评价不同种族的PK数据的相似性,通常使用图形法和模型法。图形法是研究两个种族资料分布的差异,可采用重叠系数考察分布的相似性,而模型法则是借鉴FDA群体等效性思路,用Kullback-Leibler距离度量PK数据的差异性。
③ 等效性/非劣性评价
在II/III期随机对照试验研究中,以临床终点为研究指标,借用疗效等效性/非劣效性试验的思想,和贝叶斯方法进行桥接试验。主要有等效性/非劣效性试验、群体相似性检验、一致性检验以及贝叶斯方法。
04 展望
桥接试验是一种政策法规与科学评价方法相结合的产物,设计、制定和实际研究过程对国家政策法规有很大的依赖性。桥接试验可以节约医疗成本,缩短药物上市时间,促进药物尽早上市。
ICH E5 虽然提出了“桥接试验”、“相似性”,但是并未提出评价种族基因敏感性、判断种族“相似性”的标准,以及桥接策略的统计学标准和方法。相似性评价中的重建概率法、重叠系数法、群体相似性检验;桥接策略上的成组序贯设计、加权这种方案。多中心层次模型等。
由于各种方法的桥接思想不同,这些方法的特征和优劣仍然很难比较,目前仍然缺乏统一的国际认可的桥接试验的策略和针对目标区域人群效应分析的统计学方法。因此,在实际工作中,要及时与监管部门沟通,取得监管部门的支持再进行临床试验。
参考资料
